Zuletzt aktualisiert am 3. November 2025
Das Liegetrauma ist eine unterschätzte Gefahr für unsere Patienten. Hier lernt ihr warum es ein akuter Notfall ist, welche Gefahren für den Patienten hiermit einhergehen und wie ihr weiter verfahren solltet um das Outcome eurer Patienten zu verbessern und ihre Überlebenschancen zu erhöhen. Viel Spaß dabei!

Fallbeispiel: Es ist Sonntag nachmittags. Ihr habt euch mit euren Kollegen bei der nahegelegenen Imbiss mit euren Kollegen gerade mit einem verfrühten Abendessen versorgt. Der Tag war bisher lang und seit dem Morgen seid ihr durchgerollt. Gerade wollt ihr in euren Döner beißen, da plärrt der Melder los. „Achtung, Achtung! Einsatz für 1/82-1, 1/83-3 und Florian Pusemuckel. Balduinstraße 13. Person hinter Tür.
Etwas ärgerlich und vor allem hungrig steigt ihr in euer Fahrzeug und fahrt mit Sonderrechten los.
Am Einsatzort angekommen zeigt sich, dass die Wohnung von Herr Müller im 6. Stock eines Wohnhochhauses, einer Wohnscheibe liegt – wie der Thüringer zu sagen pflegt. Der Fahrstuhl ist eng – eine Trage passt hier nicht rein. Das Treppenhaus, an dem sich der Wohnungseingang zur Wohnung von Herrn Müller befindet ist natürlich nicht besser. Der Blick über das Geländer lässt euch bis in den Keller schauen. Murphy lässt grüßen.
Vor der Wohnung trefft ihr auf die etwas aufgelöste Tochter von Herrn Müller, welche berichtet, dass sie ihren Vater zuletzt vor 2 Tagen gesehen habe. Jetzt nehme er nicht mehr das Telefon ab.
Ihr haltet Rücksprache mit dem Einsatzleiter Feuerwehr. Dieser lässt schon die Werkzeuge für die Türöffnung holen.
Herr Müller sei ein 75-jähriger Mann, welcher seit dem Tod der Ehefrau alleine in der gemeinsamen Wohnung lebe. Er habe es mit dem Herzen und die Niere sei auch nicht gesund. Am Freitag habe die Tochter ihm noch Einkäufe vorbei gebracht. Er sei nicht mehr so mobil. In der Wohnung laufe er noch mit dem Rollator.
Routiniert öffnen die Kollegen der Feuerwehr die Tür. Guten Tag! Der Rettungsdienst. – Keine Antwort. Beim Betreten der Wohnung steigt euch ein durchdringender Geruch nach Urin und Metall in die Nase. Ihr findet Herrn Müller in seinem Schlafzimmer neben dem Bett seitlich auf dem Bauch liegend. Um den Kopf hat sich eine Blutlache gebildet. Der Nachttisch ist blutverschmiert. Auf dem Tisch im Wohnzimmer stehen leere Bierflaschen. Er atmet.
Ätiologie
Was ist ein Liegetrauma? Definition des Liegetraumas
Das Liegetrauma als eigenständige Krankheitsentität ist bisher hauptsächlich im deutschsprachigen Raum bekannt, aber jedoch noch nicht einheitlich definiert. Während im englischsprachigen Literatur das „long lie“ als Risikofaktor einer erhöhten Mortalität[1] diskutiert wird, wird jedoch die im DACH Raum verwendete Symptomenkomplex des Liegetraumas nicht als eigene Entität verwendet.
Grundsätzlich wird unter dem Liegetrauma vor „allem eine durch längeres Liegen ausgelöste muskuläre Minderperfusion mit konsekutiver Gewebsschädigung , die zu einer Rhabdomyolyse führt” verstanden [2,3]
Dieser Symptomenkomplex besteht jedoch nicht nur aus den Problemen die durch die Gewebsschädigung entstehen – sondern umfasst, neben der Ursache und der Folgetraumata des Sturzes, auch einen durch das lange Liegen und umweltbedingte Komplikationen ausgelösten Teufelskreis und stellt eine ausgesprochen komplexe Krankheitsentität dar.
Ein Sturz und die Unfähigkeit sich selbst wieder auf die Beine zu helfen bedeutet für Patienten die alleine leben meist das Ende ihrer Unabhängigkeit. [1,4]
Warum kommt es zum Liegetrauma?
Liegetraumata werden in Patienten beobachtet, die nach einem Sturz nicht in der Lage sind sich selber aufzuhelfen, nicht in der Lage sind Hilfe zu holen und ungewollt in einer Position verharren, die zur Ursache des Sturzes die Patienten weitere Folgekomplikationen addiert.
Durch das Liegen ausgelöste Minderperfusion in aufliegenden Geweben führt neben der fehlenden Verfügbarkeit von Wasser, Nahrung und Medikamenten, sowie Schutz vor Einflüssen der Umwelt zu einem komplexen Symptomenkomplex.
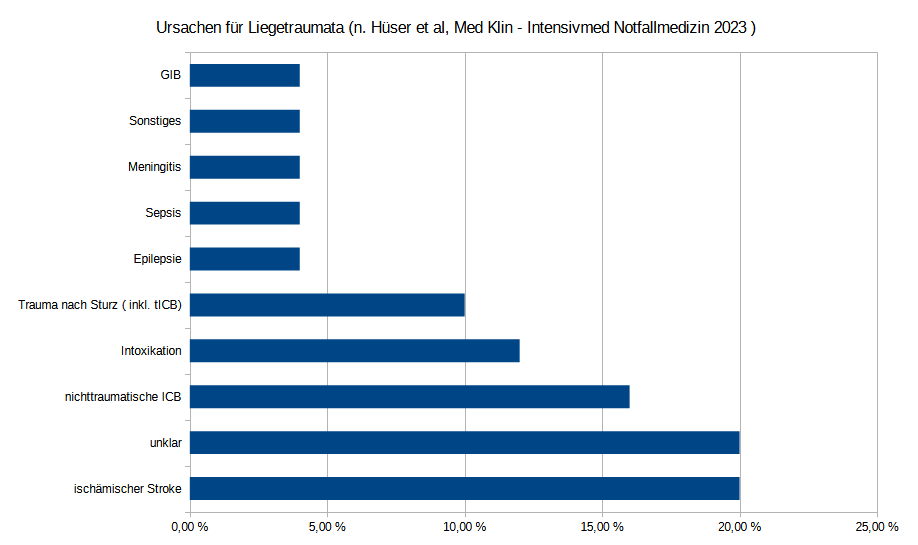
Ursächlich für den Sturz und das daraus folgende Liegetrauma sind je nach Untersuchung am ehesten neurologische Erkrankungen (ca. 40%, z.B. Stroke, nichttraumatische ICB ), Intoxikationen (ca. 12%, z.B. Alkohol oder Mischintoxikationen ) oder Traumata die durch den Sturz erlitten wurden ( ca. 10%, z.B. Schenkelhalsfraktur). In vielen Fällen bleibt jedoch die Ursache eher unklar (ca. 20%).[2] Hier bleibt jedoch anzumerken, dass nach dem Erreichen des 70. Lebensjahres die Inzidenz für Stürze stark ansteigt.[5] Hiervon schaffen es bis zu 47% der geriatrischen Patienten nicht aus eigenem Antrieb heraus aufzustehen.[4]
Wer erleidet ein Liegetrauma?
In den meisten Untersuchungen zu ground level falls (Stürze aus dem Stand) mit konsekutivem Liegetrauma überwiegt ein geriatrisches Patientengut mit einem Median zwischen 67 und 76 Jahren. Diese decken meist die gesamte Bandbreite von Sturzursachen ab, wobei bei jüngeren Patienten eher die Intoxikationen[1,6] und bei älteren kognitive Einschränkungen als Ursachen des Sturzes eine Rolle spielten.[7]
Wie ist die Prognose?
Insgesamt zeigt sich für Patienten mit Liegetrauma eher kein rosiges Bild. Die intra-hospitale Mortalität variiert je nach Publikation zwischen 25 und 50%.[2,8]. Ein langes Liegen nach Trauma hat eine Odds Ratio von 1,75(95% CI 1,15;2,67) für einen frühen Tod.[9]
Geriatrische Patienten nach einem ground level fall und längerem Liegen, die in der körperlichen Untersuchung wenig beeinträchtigt wirken, haben schon ein erhöhtes Mortalitätsrisiko (2,3%). [10]
Allein die Unfähigkeit alleine aufzustehen bedingt eine erhöhte Mortalität.[9]
Insgesamt addiert sich die Mortalität der Komplikationen durch das Liegetrauma zur Mortalität der das Liegetrauma verursachenden Erkrankungen. Diese stellen einen eigenständig das Outcome beeinflussenden Faktor dar.
Prognostische Faktoren für ein schlechtes Outcome
- Alter über 75 [10,11]
- Alter über 85 [1]
- Frailty [10,11]
- alleinlebend[1]
- längere Liegedauer [Mortalität 12% bei 1h, 67% bei >72h] [1]
- Hypothermie <35°C [12]
- reduzierter Ernährungszustand
- männliches Geschlecht (OR: 1,93; 95% CI:1,688–2,283) [1,10]
- arterielle Hypertension [10]
- Dialysepflichtigkeit/chronische Nierenerkrankung (OR: 2,508; 95% CI:1,850-3,334) [10,13,14]
- intrkranielle Blutung ( SAB,SDH) [13]
- GCS <15
- dekompensierte Herzinsuffizienz (OR: 3,88; 95% CI:3,42–4,41) [15]
- metastasiertes Krebsleiden (OR: 3,44; 95% CI: 2,27–5,20) [15]
- Störungen des Wasser und Elektrolythaushaltes (OR: 2,95; 95% CI: 2,47–3,52) [15]
- Gerinnungsstörung (OR:2,87; 95% CI: 2,08–3,96) [15]
- Lebererkrankungen (OR: 2,40; 95% CI:1,82–3,17) [15]
- erhöhter Injury Severity Score( ISS ) >15 (OR 1,117;95% CI 1,104-1,130) [10]
Prognostische Faktoren für ein gutes Outcome
- weibliches Geschlecht
- Extremitätentrauma als einzige Ursache
- Intoxikation als Sturzursache

Fallbeispiel Fortsetzung: Der Patient liegt zwischen Bett, Nachttisch und Kleiderschrank. An der Kante des Nachttisches findet ihr Blutflecken und Haare.
Ihr dreht den Patienten vorsichtig auf den Rücken und macht einen kurzen Bodycheck :
x: große Blutlache um den Kopf, große Skalpierungsverletzung am lateralen Hinterkopf, aktuell keine aktive Blutung zu sehen
A: gurgelndes Atemgeräusch, mögliche HWS Verletzung durch Sturzmechanismus
B: AF ~8//min, RGs, Lippen und Fingernägel zyanotisch verfärbt
C: Rekap >5s, Mottling Score 5, HT arrhythmisch, bradykard
D: reagiert auf SR mit Stöhnen und Flackern der Augenlider, keine motorische Reaktion ( GCS 5), Pupillen weit und lichtstarr
E: Thermometer zeigt “low”, der Patient fühlt sich peripher sehr kalt an; an der Hüfte, der Flanke, den Unterschenkeln und der Schulter auf der der Patient gelegen hatte, zeigen sich gerötete, blasige, teils offene Liegemale (Dekubitus II-III°)
Es findet sich ein Medikamentenplan. Hier zeigt sich neben einer Medikation für arterielle Hypertonie, einer Herzinsuffizienzmedikation. ein NOAK bei Vorhofflimmern. Super. Das erklärt wohl die Blutlache, denkt ihr euch.
Medizinische Probleme des Liegetraumas
Sturzursache – etwas für Detektive
Die Ursachen für den Sturz des Patienten können vielfältig sein und ziehen eine große Bandbreite an individuellen Behandlungsstrategien nach sich. Ein Sturz aus neurologischer Ursache wird anders behandelt als ein Sturz mit nachfolgender traumatischer Verletzung – die Disposition ändert sich mit der vermuteten Ursache des Liegetraumas. Oft ist diese bei bewusstseinsgeminderten Patienten nicht wirklich zu eruieren.
In unserem Fallbeispiel kann neben einer Intoxikation, eine neurologische Ursache oder eine traumatische HWS Verletzung Ursache des Liegetraumas sein. Was ist hier Henne und Ei?
MERKE Grundsätzlich gilt – aufgrund der Vielzahl der möglichen Differentialdiagnosen ist der Patient so zu behandeln, als sei ihm die schlimmste der Differentialdiagnosen zugestoßen. Ein aresponsiver Patient kann durchaus einen Schlaganfall oder eine Hirnblutung haben. Dann wird dieser so behandelt!
sekundäre Verletzungen – Henne oder Ei?
Patienten mit Liegetrauma haben meist Läuse und Flöhe – sie haben nicht nur eine Ursache für ihren Sturz, sondern meist auch noch Verletzungen durch diesen Sturz. Eine Verletzung der Wirbelsäule oder stammnahe Extremitätenfrakturen sind hier nicht selten – neben minor Traumata wie Platzwunden oder Schürfungen.
Ein ground level fall kann mit schwerwiegenden Verletzungen einhergehen. Prädiktoren für eine erhöhte Mortalität waren vor allem im geriatrischen Patientengut Stürze aus niedriger Höhe mit SHT, sowie klinisch relevante Koagulopathien. Insgesamt zeigten geriatrische Patienten einen bis zu 3,5fachen Anstieg in der Mortalität gegenüber nicht geriatrischen Patienten mit vergleichbarer Verletzungsschwere. Daher gibt es für geriatrische Patienten modifizierte Kriterien zur Schockraumaktivierung. Diese sollte großzügig erfolgen [16]
MERKE: Ein Bodycheck gehört beim Liegetrauma zur Standarduntersuchung! Der Rücken ist meist erst bei der vorsichtigen Umlagerung abzutasten.
Gewebsschädigung durch langes Liegen
Dass langes Liegen auf der Stelle ohne die Möglichkeit für die Umlagerung Gewebsschäden verursacht, wissen wir schon lange. Allein der Druck auf Gewebe kann die Mikrozirkulation und damit die Versorgung des Gewebes mit Sauerstoff und Nährstoffen so massiv beeinträchtigen, dass das betroffene Gewebe Schaden nimmt.
Je weniger Gewebe an einer Stelle vorhanden ist (z.B. durch Mangelernährung, Frailty), desto wahrscheinlicher ist dort aufgrund der mangelnden Kompensationsfähigkeit ein Gewebeschaden. Aber auch adipöse Patienten können bei ausreichend langem Druck auf Gewebe eine lokale Gewebsschädigung aufweisen. Am ehesten sind sogenannte Prädilektionsstellen wie z.B. die Haut über dem Trochanter major, dem Sakrum, den Sitzbeinhöckern oder den Fersen betroffen.
Diese können durch eine eingeschränkte Perfusion der Haut bei Zentralisierung schneller und ausgeprägter auftreten, als es normal der Fall wäre. Eine Hypothermie oder Dehydratation bei Exsikkose sind hier begünstigende Faktoren.
Weichteilschäden
Weichteilschäden sind auch unter dem Namen Dekubitus bekannt. Diese werden nach J.D.Shea in vier Grade unterteilt.
- I. nicht wegdrückbare, umschriebene Rötung intakter Haut
- II. oberflächliche Schädigung der Epidermis mit Blasenbildung oder oberflächlicher Ulzeration, Schmerzhaft
- III. tiefe Ulzeration bis ins Unterhautfettgewebe oder auf die Faszie. Sehr schmerzhaft
- IV. tiefste Ulzeration mit Verlust aller Hautschichten mit ausgeprägter Zerstörung und/oder Beschädigung von Muskeln und Sehnen, teils bis auf den Knochen.
Diese Graduierung bedeutet nicht dass diese Schäden aufeinander folgen müssen. Eine längere Liegedauer kann direkt in einem Dekubitus III-IV Grades enden.
Muskuläre Schäden (Rhabdomyolyse & Kompartmentsyndrom)
Durch langes Liegen auf einem Muskel kann es zu einer Rhabdomyolyse, einem Untergang der quergestreiften Muskulatur kommen. Diese ist aufgrund ihres erhöhten Sauerstoffbedarfs anfällig für eine Unterversorgung mit Sauerstoff und Nährstoffen wie sie durch langes Aufliegen eines Muskels zustande kommen kann. Der (partielle) Zerfall dieser Muskulatur führt zur Freisetzung intrazellulärer Bestandteile wie z.B. Myoglobin und Elektrolyten die ihrerseits weiteren Schaden im Körper anrichten. Von einer Rhabdomyolyse wird ab dem Nachweis einer CK von >1000 U/l im Blut gesprochen, sofern kein akuter Myokardinfarkt vorliegt. Kommt es beim Liegetrauma auch zu einer Verletzung des Herzmuskels (z.B. Typ II Myokardinfarkt) – ist die Interpretation des CK als Marker für die Rhabdomyolyse schwierig.[17]
Gleichzeitig kann sich durch Entzündung des verletzten Muskels v.a. in Bereichen des Unterschenkels oder des Unterarms ein sogenanntes Kompartmentsyndrom bilden. Dies bedeutet, dass aufgrund der Entzündung und des lokalen Ödems in einem streng begrenzten Kompartiment der Muskeln der Druck soweit steigt, dass in der gesamten Muskelloge die Versorgung mit Sauerstoff und Nährstoffen beeinträchtigt wird. Klinisch beginnt ein Kompartmentsyndrom mit schmerzhaft verhärteter Muskulatur und Muskeldehnungsschmerz und wächst sich zum persistierenden Muskelschmerz, welcher durch Analgetika nur schwer zu kontrollieren ist aus (Ischämieschmerz).
Zu guter Letzt kommt es hier zu Sensibilitätsstörungen. Der ischämisch unterversorgte Muskel geht dann in eine Rhabdomyolyse über und verursacht weitere Komplikationen. Kompartmentsyndrome können auch an ungewöhnlichen Stellen wie z.B. der Glutealmuskulatur auftreten. Therapie der Wahl ist hier eine chirurgische Kompartmentspaltung durch Fasziotomie. Dies sollte zeitnah in der Klinik durchgeführt werden.

Akutes Nierenversagen
Für das ANV unter Rhabdomyolyse gibt es verschiedene Erklärungsansätze [17] :
- 1.) Ausfällung von Myoglobin welches in der Niere zu Tubulusokklusionen und damit Verstopfungen der kleinen Gefäße und Absterben der urinkonzentrierenden Tubuli der Nephrone führt
- 2.) das Myoglobin wirkt durch sein hohes Redoxpotential direkt nephrotoxisch und führt zu Veränderungen in den Nephronen
- 3.) das Myoglobin wirkt durch sein Redoxpotential auch auf die Gefäße die mit einer Vasokonstriktion in den renalen Gefäßen reagieren
Das Myoglobin im Urin führt zur rotbräunlichen Farbe des Urins nach Rhabdomyolyse.
Das Zusammenwirken dieser drei Mechanismen führt zu einer fortschreitenden Schädigung der Niere bis diese dann ganz versagt. Therapie wäre hier möglichst schnell das Myoglobin los zu werden, was am besten mit forcierter Diurese gelingt – weitere komplizierende Faktoren wie eine Exsikkose oder Hypothermie führen zu weiteren schädigenden Faktoren auf die Nierengesundheit bei Patienten mit Liegetraumata.
Elektrolytverschiebungen
Durch das Liegetrauma kommt es zu Störungen der Zellintegrität, welche zu einem Überschuss von Kalzium in der Zelle führen (Störung Na/K-ATPase). Dieses kann nur bis zu einem gewissen Grad in den Mitochondrien und im Sarkolemm gespeichert werden – überschüssiges Kalzium wird dann im Zytosol gespeichert womit der natürliche Gradient ausgehebelt wird und die Zellintegrität zusammenbricht.
Zerstörte Zellen setzen ihren Inhalt frei, welcher in das umgebende Gewebe gerät. Es kann zu einer Hyperkalzämie und einer Hyperkaliämie kommen, welche bei intakter Niere von dieser reguliert würden. Da diese aber meist im Rahmen einer Rhabdomyolyse beeinträchtig ist kann es hier zu lebensgefährlicher Hyperkaliämie und Hyperkalzämie kommen. Diese können bei einer extrazellulären/intravasalen Azidose noch weiter aggraviert werden und die Gefahr für lebensbedrohliche Arrhythmien drastisch erhöhen.[17]
Hypothermie
Laut Definition spricht man von einer Hypothermie bei einer Körperkerntemperatur von <35°C, von einer schweren Hypothermie ab einer Körperkerntemperatur von <28°C.
Hypothermie <35°C ist ein unabhängiger Faktor für eine erhöhte Mortalität von Traumapatienten.
Regulär gibt es 4 Stadien der Hypothermie nach Durrer und Danzl[18]:
- Stadium I beschreibt den wachen, zitternden Patienten mit einer Körperkerntemperatur von 32-35°C
- Stadium II umfasst den nicht zitternden, bewusstseinsgetrübten Patienten mit einer Körperkerntemperatur von 32-28°C.
- Stadium III ist der bewusstlose, nicht zitternde Patient mit vorhandenen Vitalzeichen und einer Körperkerntemperatur von 28-24°C
- Stadium IV umfasst den hypothermen Patienten ohne Vitalzeichen mit einer Körperkerntemperatur von weniger als 24°C.
Hier ist anzumerken dass der Bewusstseinszustand nicht allein abhängig von der Temperatur ist – Vorerkrankungen und Sturzursache haben hier einen gewichtigen Anteil.
Die Fähigkeiten zur Thermoregulation nimmt bei geriatrischen Patienten mit zunehmendem Alter ab. Vermindertes Körperfett und vermindertes Herzzeitvolumen führen zu einem erhöhten Wärmeverlust, verminderte Muskelmasse und reduzierte Stoffwechselprozesse zu einer verminderten Wärmeproduktion.[19]
Grunderkrankungen wie Parkinson oder Herzinsuffizienz beeinflussen die Anfälligkeit für Hypothermie – sei es durch gestörte Thermoregulation, verminderte Wärmeproduktion oder erhöhten Wärmeverlust.
Intoxikationen mit Alkohol oder anderen Sedativa begünstigen auch bei nicht-geriatrischen Patienten eine Hypothermie.
Ein Schädel-Hirn Trauma oder eine neurologische Ursache des Sturzes (Stroke, Meningitis, ICB) können ebenfalls die Thermoregulation negativ beeinflussen.[18]
MERKE Hypothermie kann auch in warmen Umgebungen bei entsprechend disponierten Personen auftreten. Messung der Körpertemperatur ist Pflicht!
A/B Problem
Im sterotypischen Verlauf einer Hypothermie kommt es erst zu einer Hyperventilation aufgrund des erhöhten O2 Verbrauches durch Kältezittern (Shivering) die sich mit dem Abfall der Körperkerntemperatur zu einer Hypoventilation mit Reduktion von Atemfrequenz und Atemzugvolumen wandelt. Hieraus resultiert eine erhöhte Totraumventilation durch zu flache Atmung und ein Anstieg des CO2. [18,20] Letzteres führt dann zu einer respiratorischen Azidose. Insgesamt fällt diese jedoch weniger dramatisch aus als in vergleichbaren Fällen, da eine Hypothermie insgesamt auch die Stoffwechselaktivität reduziert.
Des weiteren spielt die Sauerstoffbindungskurve eine Rolle. Diese wird durch Hypothermie nach links verschoben – d.h. der Sauerstoffgehalt ist relativ hoch und die Abgabe durch die erhöhte Affinität des Häm zum gebundenen Sauerstoff relativ niedrig. Dies ist jedoch eher ein akademischer Effekt, da die Linksverschiebung teils durch die respiratorische Azidose aufgehoben wird. Insgesamt ist aufgrund der reduzierten Stoffwechselaktivität, der Bedarf der Gewebe an Sauerstoff reduziert.
Bei Körpertemperaturen unter 28°C kann eine Apnoe beobachtet werden. [20,20,21]
MERKE Aufgrund von Zentralisierung ist peripher keine verlässliche spO2 abzuleiten. Wir müssen aufgrund der Pathophysiologie davon ausgehen, dass der Patient hypoxäm sein könnte. Daher bekommt der Patient Sauerstoff per Nasenbrille oder Maske.[20,21]
C Problem
Mit zunehmender Hypothermie sinkt das HZV unter einer Körperkerntemperatur von 30°C. Bei 25°C ist diese bei 45% der Ausgangsleistung angekommen. Dies geschieht initial durch einen verstärkten Afterload (Zentralisierung), eine abnehmende Herzfrequenz und eine fehlende Kalziumsensitivität ( neg. Inotropie). [18]
EKG Veränderungen – Bradykardie, Osborn und Co.
Nachdem bei milder Hypothermie eher die Aktivierung des Sympathikus mit Tachykardie und Erhöhung von Blutdruck im Vordergrund steht, kommt es ab ungefähr einer Körpertemperatur von 32°C zu einer durch die Hypothermie induzierten Störung der kardialen Reizleitung. Es kommt zu einer linearen Abnahme der Herzfrequenz ( ca.50% der Baseline @28°C ) bis zur Asystolie bei ca. 18°C. [18]
CAVE Die hypothermie-induzierte Bradykardie reagiert nicht auf Atropin und schlecht auf Adrenalin! [18]
Des weiteren verlängert (=verbreitert) sich durch die veränderte Reizleitung das Aktionspotential, welches zu einem breiten QRS-Komplex und einer verlängerten QT-Zeit führt. Hier zeigt sich auch eine Veränderung des QRS-Komplexes – die sogenannte “Osborn Welle”. Diese zeigt sich vor allem in den Ableitungen II und V4-V6 als “Kamelhöcker” am J Punkt. Diese kann jedoch auch bei ZNS Erkrankungen oder Verletzungen, myokardialen Erkrankungen oder etwa Hyperkalzämie auftreten. [18,22–24]. Diese ist bei 80% der hypothermen Patienten mit einer Körperkerntemperatur <28°C vorhanden – je hypothermer desto häufiger. Die Höhe der Osborn Welle ist proportional zum Ausmaß der Hypothermie.[25]
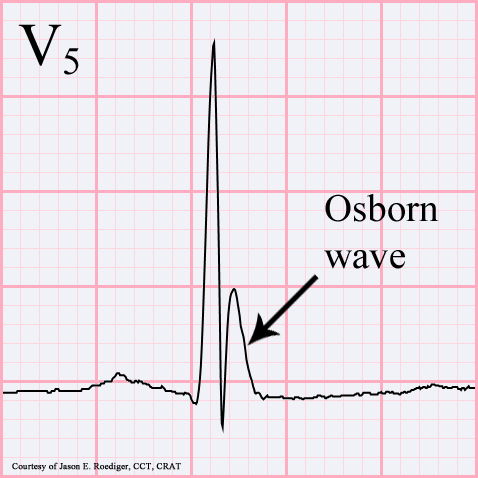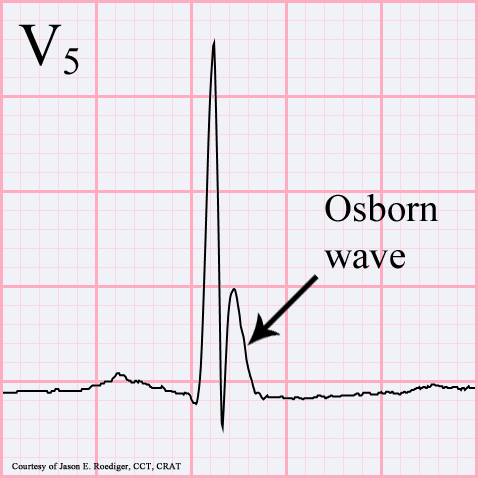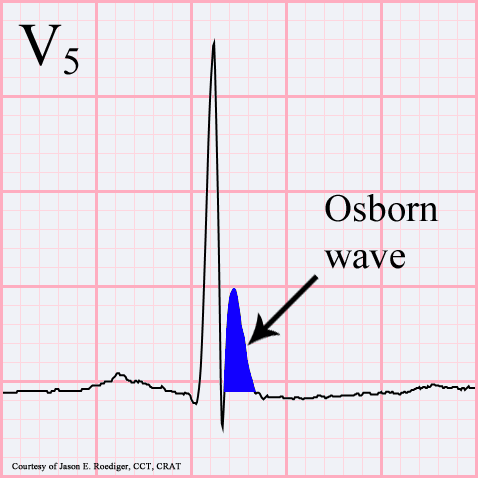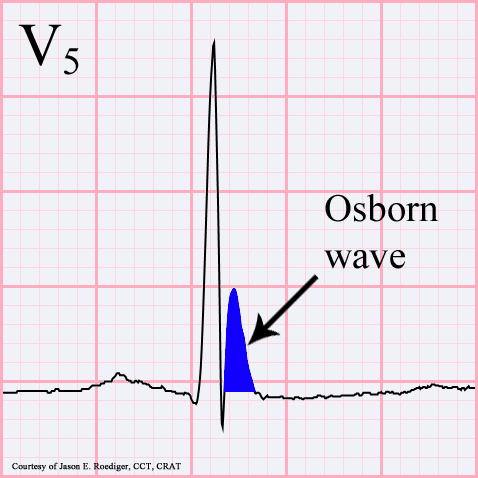
Abbildung Osborn Wave : 81j,m, RR 80/62,Temp 31,9 Jason E. Roediger (Jer5150), CC BY-SA 3.0 https://creativecommons.org/licenses/by-sa/3.0, via Wikimedia Commons
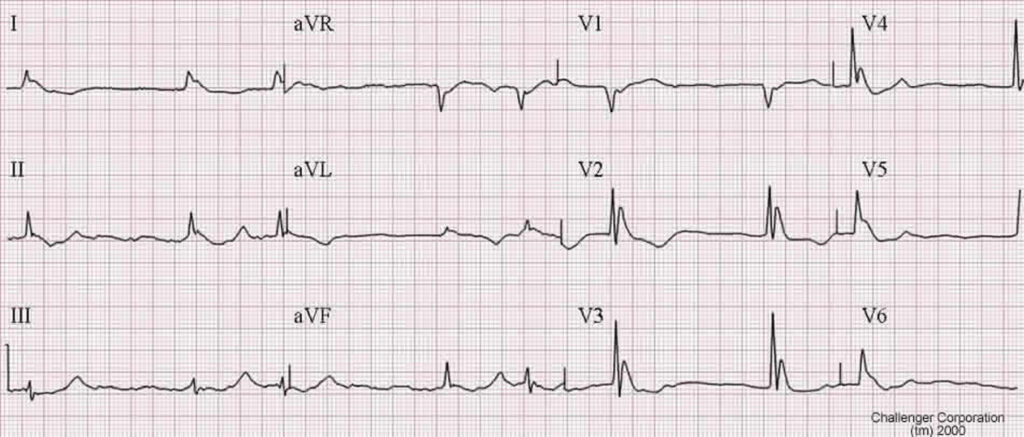
Abbildung : Osborne + VHF Patient mit Vorhofflimmern und Osborn Welle unter Hypothermie WikiSysop, CC BY 3.0 https://creativecommons.org/licenses/by/3.0, via Wikimedia Commons
Zur Osborn Welle hat LIFL ECG Library einen guten Artikel.
Zudem reduziert sich das transmembranöse Ruhepotential, welches in Kombination mit der verlängerten QT-Zeit zu einer erhöhten Anfälligkeit für Arrhythmien führt. Bei 22°C Körperkerntemperatur besteht die höchste Anfälligkeit für Kammerflimmern.[18]
Zentralisierung und Mottling Score
Einer der Schutzmechanismen des Körpers um sich gegen eine zentrale Hypothermie zu schützen besteht aus einer Reduzierung der Haut- und Extremitätenperfusion. Dieser Schutzmechanismus ist ebenfalls bei Hypovolämie zu beobachten. Die initiale Zentralisierung ist Folge der Sympathikusaktivierung, mit zunehmender Hypothermie ist zudem eine Reduktion des Herzzeitvolumens zu beobachten. Dies führt zu einer weiteren Abnahme der peripheren Perfusion. Eine Pulsoxymetrie ist aufgrund der Vasokonstriktion und der zunehmend schlechter werdenden Perfusion nicht in der Lage eine verlässliche Ableitung der Pulsstromkurve und damit der peripheren Sauerstoffsättigung zu liefern.
Klinische Zeichen für die Zentralisierung sind neben der Rekapillarisierungszeit auch die bei fortschreitender peripherer Durchblutungsstörung zunehmende retikuläre Hautzeichnung welche sich vom Knie ausgehend auf das Bein ausbreitet ( “mottling” ). Dieses tritt nicht nur bei Hypothermie auf sondern bei allen Störungen der Mikrozirkulation wie z.B. Sepsis und ist hier ein leicht zu erfassender Prädiktor für die 14d Mortalität nach initialer resuscitation.[26–28] Der Einfluss auf die Mortalität von hypothermen Patienten ist bisher nicht validiert.
Der Mottlingscore ist in 6 Schweregrade von 0 = kein Mottling bis 5 = Mottling bis über die Leistenfalte unterteilt.
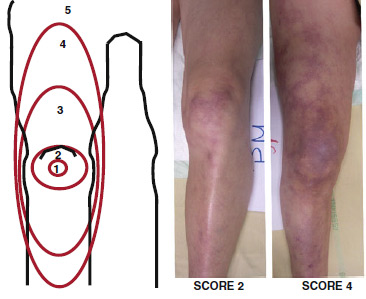
Unter 24°C versagt jedoch die Vasokonstriktion, wird aber durch eine fortschreitende Reduktion des HZV ausgeglichen.[18]
Wie der Afterdrop zum Bergungstod führt
Als Afterdrop bezeichnet man den Temperaturausgleich zwischen dem wärmeren Körperkern und der kälteren Außenschicht. [21] Dieser findet normal relativ langsam statt, kann jedoch durch ruckartige Bewegungen des Körper, eine gesteigerte Durchblutung (RR+) beschleunigt werden und kann auch nach Beendigung der Kälteexposition erfolgen. Dies ist bei Patienten mit milder Hypothermie (Stadium I) unangenehm, kann aber bei ausgeprägterer Hypothermie (ab Stadium II) zu malignen Herzrhythmusstörungen und Hypotension aufgrund der Hypovolämie führen, die im schlimmsten Fall untherapiert den sogenannten Bergungstod verursachen.[18,20,29]
D Problem
Hypothermie hat einen großen Einfluss auf Wachheit und Bewusstseinszustand und führt mit zunehmender Abkühlung zu einer Abnahme bis zum Bewusstseinsverlust. Dies kann durch Vorerkrankungen, die Sturzursache, ein SHT oder Intoxikationen aggraviert werden.
Dies beginnt ab einer Verminderung der Körperkerntemperatur von ungefähr 4°C. Ab hier zeigen sich transiente Verhaltensänderungen wie Desorientierung, Amnesie, Apathie, Dysarthrie und Ataxie. Es zeigen sich anfangs Verhaltensstörungen wie z.B. paradoxial undressing. Patienten entledigen sich hier oft ihrer Kleidung, sofern sie dazu körperlich in der Lage sind.
Das Bewusstsein geht für gewöhnlich unter 30°C Körperkerntemperatur verloren. Die Pupillen werden ab 28°C KKT dilatiert und reagieren nicht mehr auf Lichtreize. Periphere Reflexe gehen ab einer KKT von 30°C verloren. Die protektiven Atemwegsreflexe gehen je nach Literatur ab <30°C verloren. [18]
Hypothermie führt zu einer Reduktion des Hirnstoffwechsels und wirkt dadurch protektiv gegenüber Sauerstoffmangel.
E Problem
Shivering stellt ein Problem zwischen 37°C und 35°C Körpertemperatur dar. Hier versucht der Körper mit intakter Thermoregulation durch Muskelzittern die Körperkerntemperatur auf den Sollwert anzuheben. Dies ist unglaublich energieintensiv und verbraucht viel Sauerstoff. Bedeutet beim Patienten mit KHK dass durchaus aufgrund der Sauerstoffausschöpfung ein Typ II Myokardinfarkt entstehen kann.
Beim geriatrischen Patienten, beim intoxikierten Patienten und bei allen anderen Patienten wo die Temperaturregelung nicht mehr so gut funktioniert kann dies komplett aufgehoben sein.
Die Kälte führt ebenso zur Vasokonstriktion peripherer Gefäße. Dies erhöht das intravaskuläre Volumen in zentralen Gefäßen, worauf zentral eine ADH-Ausschüttung gehemmt wird. Dies führt zur kälteinduzierten Diurese ähnlich einem zentralen Diabetes insipidus.[30] Die Folge sind Exsikkose und akutes Nierenversagen.
Exsikkose
Ein Patient der längere Zeit liegt und nicht in der Lage ist sich von seiner Position zu bewegen hat seltenst Zugang zu Nahrung und vor allem Wasser. Dies wäre bei normaler Nierenfunktion erst einmal nicht wirklich schlimm, da diese bei Wassermangel die Rückgewinnung von Flüssigkeit forciert und der Urin somit “konzentrierter” wird. Mehr Solute, weniger Flüssigkeit.
Leider führen jedoch mehrere Faktoren während eines Liegetraumas zu einer Steigerung der Diurese.
Die Hypothermie kann durch Zentralisierung und Verschiebung des intrazellulären Volumens nach intravasal zu einer zentralen ADH-Suppression führen. Diese führt dann zu einem Diabetes insipidus und weniger konzentriertem Urin. [20]
Die Rhabdomyolyse kann ebenfalls die Diurese verstärken in dem sie hochmolekulares Myoglobin und Häm freisetzt welches dann osmotisch das intravasale Volumen noch erhöht und zur Diurese führt.[17]
Der daraus entstehende intravasale Volumenmangel führt zu Durst, Kopfschmerzen und einer zunehmenden Schläfrigkeit und Benommenheit. Es verstärkt die körperliche Schwäche und führt zu einer Hyperkoagulabilität, welche die Thromboseneigung des Patienten verstärkt.
Das häufig im Rahmen der Exsikkose auftretende akute Nierenversagen wird durch die Induzierung renaler Vasokonstriktion durch Aktivierung des RAAS und oft gleichzeitiger Sympathikusaktivierung induziert. Hier kommen dann weitere Faktoren wie die Rhabdomyolyse, infektiöse Verletzungen der Niere etc. zum Tragen die das Problem nur noch potenzieren.
Zu guter Letzt erhöht dies die Anfälligkeit für aufsteigende Infektionen des Harntraktes.
Infektionen
Die Hypothermie führt zu einer Reduktion der bronchialen Zilienmotilität.[18,20] Durch die ebenfalls beeinflusste Vigilanz und damit abnehmende Schutzreflexe führt dies zu einer Begünstigung bronchopulmonaler Infekte wie einer Pneumonie. Diese sind in der Kohorte von Hüser et al. die häufigste assoziierte Infektion (69% der Liegetrauma-Patienten) und wurde am ehesten mit einer Aspiration bei Bewusstseinsminderung in Verbindung gebracht.[2]
Wie oben schon beschrieben führt die im Liegetrauma immanente Exsikkose zu einem erhöhten Risiko für aufsteigende Harnwegsinfekte. Dies ist vor allem aufgrund der Stase bei unzureichender Entleerung der Harnblase und der physiologischen Reduzierung eines weiteren Urinstroms der Fall. Dies wurde in der Kohorte von Hüser et al zu 23% in ihren Liegetrauma-Patienten gefunden. [2]
Ein weiteres Einfallstor für Infektionen bietet die Haut über durch das Liegetrauma oder den Sturz verletzten Stellen. Die Zentralisierung führt zu einer geringeren Durchblutung und somit einer geringeren Aktivität der humoralen Immunreaktion am Ort der Verletzung. Daher sind diese Wunden als infiziert zu betrachten.

Fallbeispiel Fortsetzung: Ihr saugt klares Sekret aus dem Rachen ab und etabliert einen Wendl. Atemwege sind jetzt frei. Danach appliziert ihr 6l O2 per Maske. Währenddessen etabliert ein Teammitglied das Monitoring.
spO2 peripher nicht messbar, Kurve nicht darstellbar, auch nicht nach Wechsel auf die Ohrläppchen oder Nase.RR 120/45 EKG : bradykarde, absolute Arrhythmie mit HF 40-55bpm.
Ihr etabliert einen venösen Zugang unter Schwierigkeiten und der Zugang scheint nur geringfügig rückläufig zu sein. Der Patient erhält eine kristalloide Infusion. Der BZ ist mit 7,8mmol/l (141mmol/l) nicht auffällig. Ihr deckt die Skalpierungsverletzung am Hinterkopf steril mit einem Kopfverband ab. Währenddessen kommt ein Feuerwehrmann des noch vor Ort gebliebenen HLF mit der Vakuummatratze und der Schaufeltrage aus dem Hausflur. “Ich hab euch die Trage schonmal vorgestellt und dachte das könntet ihr brauchen”.
Behandlung des Liegetraumas
Behandlung kritischer xABC Probleme
MERKE Nobody is dead, until warm and dead! Hypothermie kann zu einer Vita minima führen, daher ist hier aufgrund der Bradykardie, der Hypotension und der Bradypnoe ein längerer Pulscheck indiziert. Besteht ein Herz-Kreislauf Stillstand ist hier kritisch zu prüfen :1) Ursache Hypothermie? 2) Liegedauer abzuschätzen? 3) mit dem Leben nicht vereinbare Verletzungen (z.B. eingefrorene Körperteile)? und ggf. eine Reanimation zu beginnen.[18,21,29]
X:
Durch den Sturz ausgelöste Blutungen wie z.B. in unserem Fallbeispiel die Skalpierungsverletzung sind, sofern sie nicht primär tödlich waren, direkt mit blutstillenden Maßnahmen wie z.B. Druckverband oder Tourniquet zu behandeln, da eine Wiedererwärmung bei akzidenteller Hypothermie und Zentralisierung bei Hypovolämie zu einer Wiedereröffnung der verletzten Gefäße kommen kann. Dies kann im schlimmsten Fall zu einem raschen Verbluten des Patienten führen. Daher ist eine kurzzeitige weitere Beeinträchtigung der Mikrozirkulation durchaus hinnehmbar.
Airway/Breathing:
Rein grundsätzlich ist nicht sicher festzustellen ob der Patient hypoxäm ist. Die Zentralisierung führt oft zu blau verfärbten Akren, die Pulsoxymetrie ist nicht wirklich verlässlich. Daher wäre es aufgrund der Pathophysiologie (Hypoventilation, Linksverschiebung Sauerstoffbindungskurve) sinnvoll dem Patienten auf Verdacht Sauerstoff zu geben um den physikalisch gelösten Sauerstoff im Blut zu erhöhen. Dies ist vor allem bei Hypothermie sinnvoll, da sich Sauerstoff in kälterem Blut zu einem höheren Anteil löst.
Der Atemweg kann aufgrund der oft begleitenden Bewusstseinsminderung nicht wirklich sicher sein. Dies äußert sich in Zeichen der Atemwegsverlegung wie Schnarchen oder Gurgeln.
Zuerst sollte man immer versuchen den Atemweg mittels einer supraglottischen Atemwegshilfe wie Wendl oder Guedeltubus zu stabilisieren. Wenn dies möglich ist dann vermeidet man eine Intubation des Patienten.
Eine Atemwegssicherung mittels Intubation bringt eine Menge Nachteile mit sich – allein die Narkose hierfür öffnet periphere Gefäße, senkt den systemischen Blutdruck bei Hypovolämie und ermöglicht den sonst nur durch ruckartige Bewegung des Patienten auslösbaren Afterdrop. Daher ist es immer eine Abwägung ob dies jetzt wirklich sein muss.[21]
Anders schaut es jedoch aus wenn der Atemweg nicht sicherbar oder durch Erbrechen gefährdet ist. Auch medizinische Gründe wie ein Verdacht auf eine intrakranielle Blutung oder eine höhergradige Pneumonie mit zusätzlich gestörtem Gasaustausch kann eine Intubation sinnvoll erscheinen lassen. Hier ist Nutzen gegen Schaden abzuwägen.
Wichtig ist den Patienten vor der Intubation mittels Flüssigkeit und Katecholaminen soweit zu stabilisieren, dass dies nicht in einer Reanimationssituation endet. Ketamin ist das Induktionsmedikament welches am wenigsten zu einer Vasodilatation führt.[18,20,21] Dieses sollte primär verwendet werden. In einer Reanimationssituation sollte primär der Atemweg mittels ITN oder SGA gesichert werden[18,20,21]
MERKE Eine Intubation eines Liegetraumas erfolgt unter Nutzen/Risiko Abwägung. Narkose kann hier ohne passende Resuscitation mehr Schaden als Nutzen verursachen. Induktion mit Ketamin ist am Vorteilhaftesten.[18,20,21]
Die amerikanische Guideline der Wilderness Medical Society empfiehlt für Patienten mit einer Körperkerntemperatur <28°C (Stadium III )die invasive Sicherung des Atemwegs, sei es durch Tubus oder SGA.[29]
CAVE Zur Relaxierung sollte aufgrund des möglichen Nierenversagens, der Kaliumfreisetzung durch das Liegetrauma in keinem Fall Succinylcholin verwendet werden – Gefahr der nicht zu therapierenden Hyperkaliämie mit maligner Arrhythmie.
Bezüglich der Beatmungseinstellungen sollte eine Normoventilation angestrebt werden ( AF 10-12, Vt 6-8ml/KG IBW).[20] Hier herrschen jedoch Kontroversen – die WMS Practice Guidelines for Hypothermia empfehlen hier bei Einsatz eines Endotrachealtubus die Atemfrequenz auf die Hälfte normalen Atemfrequenz zu vermindern (6-8/min) und ansonsten diese bei den normalen Parametern zu belassen.[29]
CAVE Aufgrund der verminderten Stoffwechselaktivität kann das etCO2 vermindert sein. Es sollte nur bedingt zur Steuerung der Beatmung verwendet werden. Insgesamt wird eine Normoventilation mit Hypo-/Normokapnie angestrebt.[20] Auch hier weichen die amerikanischen Guidelines ab und empfehlen eine Steuerung nach etCO2.[29] Kontrollierte, randomisierte Studien fehlen hier.
Circulation:
Das Liegetrauma hat viele Faktoren die bezüglich der kardiovaskulären Situation zusammenspielen – Hypovolämie durch Exsikkose und Kältediurese, Verminderung des HZV, zunehmende Bradykardie und Arrhythmiegefahr durch die begleitende Hypothermie.
Daher sollte bevor weitere Maßnahmen (v.a. die Umlagerung) durchgeführt werden ein kardiales Monitoring etabliert werden um auf kardiale Arrhythmien zu reagieren.[18,20,21,29]
MERKE Es kann bei Hypothermie schwierig sein einen periphervenösen Zugang zu etablieren. Hier gilt wie bei jedem kritischen Patienten – der IO Zugang ist dein Freund!
Die kälteinduzierte Bradykardie reagiert nicht auf Atropin und je nach Temperatur auch nur in geringem Maße auf Epinephrin (unter 30°C gar nicht). Daher machen Therapieversuche hier bei insgesamt reduzierter Stoffwechselaktivität keinen Sinn.[20] Transkutanes Pacing kann bei einer KKT von 30-35°C bei Hypotonie versucht werden – jedoch gibt es hier nur Fallberichte die einen möglichen Benefit herausstellen.[29]
Eine Volumentherapie mit kristalloider Lösung ist aufgrund der Gefahr des Afterdrops und der pulmonalen Überwässerung bei eigentlich bestehender Hypovolämie ein zweischneidiges Schwert. Eine vorsichtige Volumentherapie als Bolusgaben wird nicht schaden[29] – jedoch sollte zum Anheben des Blutdrucks eher auf Katecholamine zurückgegriffen werden. Diese sind jedoch bei KKT unter 30°C weniger bis gar nicht wirksam.[29]
MERKE Zwischen 30°C-35°C KKT sollten Medikamente in der üblichen Dosis gegeben werden, jedoch sollten Dosisintervalle aufgrund der veränderten Kreislauf- und Stoffwechselsituation etwa doppelt so lang sein![29]
Sollte bei einer Hypothermie Stadium III/IV eine Reanimation notwendig werden sind hier unter einer KKT von 30°C eher BLS Maßnahmen indiziert. Diese werden bei fehlenden Kontraindikationen durchgeführt bis der Patient eine KKT >35°C erreicht hat. Hier ist bei gegebener Indikation der Transport in ein Krankenhaus mit ECMO Fähigkeit und Kapazität nach Rücksprache mit demselbigen indiziert. Es gibt Fallberichte dass Patienten nach einer Reanimationszeit von 6,5h unter Hypothermie mit gutem neurologischem Outcome gerettet werden konnten.[21]
Defibrillation ist unter 30°C KKT meistens erfolglos. Hier sollten maximal 3 Defibrillationsversuche durgeführt werden und dann der BLS Algorithmus bis zur Wiedererwärmung auf mindestens 35°C weiter geführt werden.[21]
MERKE Der Einsatz einer mechanischen Reanimationshilfe (z.B LUCAS )ist aufgrund der Notwendigkeit der Fortführung der Reanimation unter Transport hier ein gutes Hilfsmittel.
Wärmeerhalt
Hier gilt: Es sollten weitere Wärmeverluste vermieden werden! Nasse Kleidung sollte wenn möglich entfernt werden. Eine Rettungsdecke zur Isolation des Patienten ist hier das Minimum an Wärmeerhalt. Besser wäre natürlich eine Decke mit aktiver Erwärmung (z.B. Techtrade Ready-Heat II ). Gegebenenfalls ist eine zweite Schicht (z.B. Decke) empfehlenswert.
MERKE Der RTW sollte auf die höchstmögliche Innentemperatur vorgeheizt werden.[29]
Infusionen sollten wenn möglich gewärmt sein, jedoch sollte auf die Infusion großer Volumina erwärmter Flüssigkeiten präklinisch verzichtet werden. Im Verlauf haben hypotherme Patienten einen großen Flüssigkeitsbedarf unter Wiedererwärmung, ohne diese führt es eher zur Überwässerung des Patienten mit den daraus resultierenden Problemen wie z.B. Lungenödem. [29]
Ein intubierter Patient sollte eine ösophageale Temperaturmessung erhalten, soweit vorhanden.[29] Wenn nicht anders möglich kann die Temperatur auch epitympanal (Ohrthermometer) gemessen werden.[29] Hier bestehen jedoch Limitationen aufgrund der messbaren Temperatur.
Schonende Immobilisierung
Abgesehen von dem möglichen Trauma durch den Sturz, sollten Patienten mit Liegetrauma möglichst schonend in der Horizontalen bewegt und immobilisiert werden um den Bergetod zu vermeiden. Rettung mittels Schaufeltrage und Vakuummatraze scheint hier am besten geeignet. Eine Rettung und der Transport auf einem Spineboard kann Hautschäden durch das Liegetrauma noch aggravieren.
Wenn ein vorsichtiger Transport aus dem Einsatzbereich zum RTW nicht möglich ist sollten Alternativen gefunden werden (s. Disposition-Rettung).
MERKE Ein EKG-Monitoring sollte etabliert werden, bevor der Patient bewegt wird! Nur dann sind Arrhythmien während der Rettung erkennbar.
Flüssigkeitszufuhr
Ein Patient mit Liegetrauma ist in den meisten Fällen hypovoläm. Fehlende Zufuhr, erhöhte Ausscheidung führen zur intravasalen Hypovolämie. Kristalloide Lösungen sind die Basis der Flüssigkeitstherapie. Diese sollten wenn möglich erwärmt sein. Jedoch sollte auf eine großvolumige Flüssigkeitstherapie aufgrund des Risikos der Überwässerung, der weiterhin bestehenden ADH-Supression und des möglichen Eröffnen von peripheren Gefäßen, womit sich das Risiko des Afterdrop beim höhergradig hypothermen Patienten erhöht, verzichtet werden. Kreislauftherapie ist hier vorrangig, bei verminderter Wirksamkeit bei schwerer Hypothermie oder Azidose, mit a-Agonisten wie Noradrenalin durchzuführen.

Fallbeispiel Fortsetzung: Der Patient erhielt bei trotz der Hypothermie gutem Venenstatus 2 großlumige Braunülen die ihr mit einer gewärmten Infusion aus dem RTW bestückt. Er wird komplett aus seiner nassen Kleidung herausgeschnitten, die offenen Wunden provisorisch abgedeckt und der Patient in eine Rettungsdecke gewickelt. Diese wird noch mit einer Decke bedeckt.
Ihr rettet den Patienten mit einer Schaufeltrage und verpackt den Patienten vor der Rettung mit der inzwischen aufgebauten Drehleiter auf die in der Schleifkorbtrage liegende Vakuummatraze.
Währenddessen telefoniert euer Notarzt mit der Leitstelle um herauszufinden welches Traumazentrum mit ECMO Fähigkeiten Kapazitäten aufweist und um einen RTH an den Ort des Geschehens zu bekommen. RTH ist nicht verfügbar. Nächstes Traumazentrum mit ECMO Fähigkeit (Maximalversorger) ist 30 Fahrminuten entfernt und aufnahmebereit.
Euer Notarzt meldet den Patienten als schockraumpflichtigen, kritischen Patienten mit x/B/C/D/E Problem als Liegetrauma mit traumatologischem und neurologischem Behandlungsbedarf und ggf. ECMO Bedarf an.
Währenddessen bugsiert ihr unter fortgesetzter Monitorkontrolle den Patienten mit der Schleifkorbtrage auf die Drehleiter. Unten angekommen wird der Patient mit der Vakuumatraze auf die bereitstehende Trage und dann in den vorgewärmten RTW verbracht.
Kurzes 10 for 10. Ihr seid abfahrbereit. Ihr fahrt im Konvoi mit dem NEF los.
Disposition
Rettung des Patienten

Aufgrund der oft auftretenden Hypothermie, sowie der möglichen Begleitverletzungen ist eine möglichst schonende Rettung des immobilisierten Patienten erforderlich.
Sofern die Umgebungszustände dies zulassen (breites Treppenhaus, ausreichend großer Fahrstuhl, Platz zum rangieren in der Wohnung) kann die Rettung über konventionelle Wege erfolgen. Jedoch ist auch hier eine Abwägung zu treffen – ob diese schonend genug für den Patienten und für die Retter sicher genug erfolgen kann. Wenn nicht, sollte die Hilfe der Feuerwehr zur weiteren Rettung in Anspruch genommen werden. Manchmal ist die Rettung mittels Drehleiter die einzig sichere und schonende Option für Patient und Rettungsdienstpersonal. Hier hilft euch die Feuerwehr eures Vertrauens sicher gerne weiter!
Bei längeren Strecken in die Zielklinik (>15min bodengebundener Transport) oder schlechtem Straßenzustand ist der primäre Transport mit dem RTH/ITH zu erwägen.
Schockraumkriterien nicht-traumatologischer und traumatologischer Schockraum
Aufgrund der vielen Veränderungen beim Patienten mit Liegetrauma wird der Patient mit steigender Liegedauer, Begleitverletzungen und Umwelteinwirkungen immer mehr beeinträchtigt. Die Ursache des Sturzes und die Folgen desselbigen wirken so lange auf den Patienten ein bis diese diagnostiziert und beseitigt sind. Ein Großteil der Patienten ist kritisch krank.
Die Empfehlungen für den nicht-traumatologischen Schockraum sehen neben den Zeichen einer massiven Organdysfunktion, das Liegetrauma als eigene Entität die eine Schockraumalarmierung rechtfertigt. Dies wird mit der Vielzahl der umfassten Probleme gerechtfertigt, welche neben Bewusstseinsstörungen, kardiozirkulatorischen und respiratorischen Problemen auch die Hypothermie umfassen.[31]
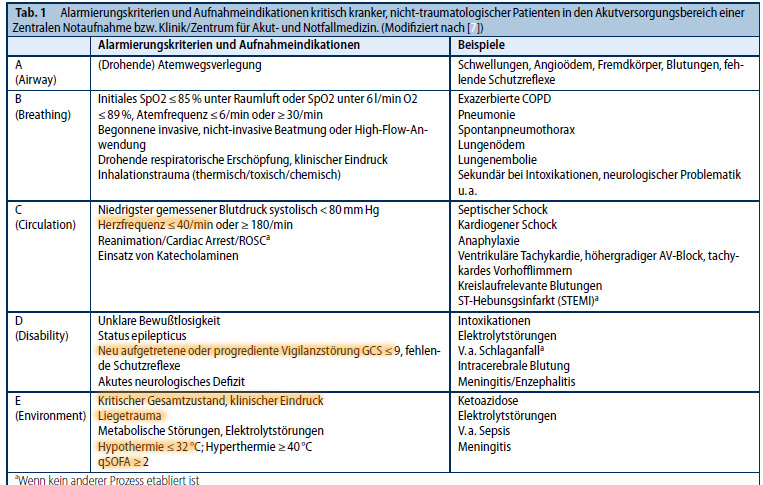
Die neue S3 Leitlinie zur Polytrauma/Schwerverletztenbehandlung sieht neben traumatischen Verletzungen die Störungen der Vitalfunktionen mit einem GCS<12, einer Atemfrequenz <10 und einer Hypothermie <35°C als ausreichende Alarmierungskriterien für einen Schockraum an. Dies sollte vor allem bei geriatrischen Patienten großzügig gehandhabt werden. Bei diesen reicht auch ein GCS <14 bei einem bekannten oder vermuteten SHT aus um eine Alarmierung zu triggern.[16]

Grundsätzlich ist ein multidiziplinärer Schockraum das, was die optimale Versorgung des Patienten gewährleistet – daher sollte die Anmeldung ungeachtet der vor Ort vorhandenen Schockraumkonzepte als schockraumpflichtiger Patient erfolgen mit dem Hinweis welche Fachrichtungen wahrscheinlich zusätzlich benötigt werden.
Auswahl der Zielklinik
Sturzursache
Die vermutete Sturzursache kann die Klinikwahl deutlich einschränken. Zwar muss jede Klinik die an der Notfallversorgung teilnimmt in der Lage sein eine Erstversorgung des Patienten sicher zu stellen – jedoch macht es wenig Sinn bei einem vermuteten Stroke eine Klinik ohne Neurologie/Neurochirurgie anzufahren. Hier kann es Sinn machen frühzeitig an die RTH/ITH Alarmierung zu denken und einen Lufttransport in eine Klinik mit diesen Fähigkeiten zu organisieren.
Begleitverletzungen
Der zum Liegetrauma führende Sturz kann weitere Verletzungen wie Schädel-Hirn Traumata oder andere Verletzungen des Stamms oder der Extremitäten nach sich ziehen. Sollten diese im Bodycheck auffallen ist die Patientenvorstellung in einem regionalen oder überregionalen Traumazentrum aufgrund der weiteren Probleme eines Liegetraumas und der daraus resultierenden kritischen Erkrankung sinnvoll.
Ausmaß der Hypothermie
Patienten mit Hypothermie der Stufe I-II sollte jedes Krankenhaus versorgen können. Ab der Stufe III (<30°C KKT) und instabilen Kreislaufverhältnissen oder gar Reanimationssituation (Stufe IV) sollte über ein Krankenhaus mit den Fähigkeiten zur Wiedererwärmung mittels vaECMO/HLM nachgedacht werden und diese Häuser frühzeitig angefragt werden.[20] Ein Lufttransport ist hier bei Transportwegen über 30 min indiziert.
MERKE Insgesamt ist bei einem Liegetrauma die Mortalität deutlich erhöht – hier bedarf es der Rücksprache mit dem ECMO Zentrum ob die ECMO in diesem Fall überhaupt sinnvoll durchzuführen und indiziert ist. Daher teilt dem Zentrum alles mit was ihr wisst. Wichtig sind hier v.a. Liegedauer, vermutete Ursache des Liegetraumas, Vorerkrankungen, vorheriger Zustand (Gebrechlichkeit? Fitness? Einschränkungen des täglichen Lebens?)
Fallbeispiel Fortsetzung: An der Klinik angekommen werdet ihr in den Schockraum gelotst. Hier wartet das komplette Schockraumteam mit ECMO Bereitschaft auf eure Übergabe. Der Schockraumleader vergewissert sich, dass es aktuell während der Übergabe kein interventionsbedürftiges Problem gibt.
“Guten Tag. Mein Name ist Sebastian, Notfallsanitäter. Ich bringe euch Herr Müller, 75j, welcher mit unklarer Liegedauer bewusstseinsgetrübt nach Sturz in der Wohnung lag. Zuletzt wurde er von seiner Tochter vor 2 Tagen gesehen. Wir fanden Herrn Müller in seinem Schlafzimmer liegend mit einer großen Skalpierungsverletzungsverletzung vor, welche bei unserem Eintreffen nicht mehr blutete. Er hatte einen verlegten Atemweg, welcher mittels Wendltubus stabilisiert wurde. Eine Sauerstoffsättigung konnte nicht abgeleitet werden, jedoch zeigten sich über beiden Lungen Rasselgeräusche. Im EKG zeigte sich eine Bradyarrhythmie mit einer Frequenz von 40bpm bei einem Blutdruck von 120/80. Wir haben 2 gut laufende Viggos grün etabliert. Bei Eintreffen zeigte der Patient einen GCS von 5. Der BZ war mit 7,8mmol/l im Normbereich. Eine Körpertemperatur war nicht messbar und der Patient zeigt Liegemale an der Hüfte links, der Flanke links, den Unterschenkeln links und der Schulter links. Der Patient hatte eingenässt und lag in einer großen Blutlache. Allergien sind nicht bekannt. Bezüglich der Medikation ist ein NOAK und Herzinsuffizienzmedikation bekannt. Die Tochter konnte keine weitere Auskunft zu den Vorerkrankungen geben. Wann die letzte Nahrungsaufnahme stattfand ist unbekannt, jedoch standen im Wohnzimmer viele leere Bierflaschen. Eine Alkoholintoxikation als Ursache des Sturzes ist nicht unwahrscheinlich. Wir haben den Patienten nachdem wir die Wunde am Hinterkopf mit einem Druckverband gesichert haben, immobilisiert und zu euch verbracht. Vielen Dank!”
Der Schockraumleader fasst eure Übergabe zusammen und ihr lagert gemeinsam um.
Fazit
Das Liegetrauma ist eine komplexes Krankheitsbild welches sich in einem Teufelskreis der kontinuierlichen Verschlechterung befindet, je länger die Liegedauer wird. Während die Prognose vorrangig durch die Sturzursache bestimmt wird, sind die Vorerkrankungen und die Liegedauer weitere Prädiktoren für ein Outcome. Exsikkose, Hypothermie und das eigentliche Trauma des Liegens haben massiven Einfluss auf das Outcome eures Patienten. Daher ist ein behutsamer, zügiger und zielgerichteter Umgang mit diesen Komplikationen für eure Patienten überlebenswichtig.
Literaturverzeichnis
[1] Gurley RJ, Lum N, Sande M, et al. Persons Found in Their Homes Helpless or Dead. N Engl J Med 1996; 334: 1710–1716. doi:10.1056/NEJM199606273342606
[2] Hüser C, Hackl M, Suárez V, et al. Liegetrauma: retrospektive Analyse einer Patientenkohorte aus einer universitären Notaufnahme. Med Klin – Intensivmed Notfallmedizin 2023; 118: 220–227. doi:10.1007/s00063-022-00912-w
[3] Ratcliffe PJ, Ledingham JG, Berman P, et al. Rhabdomyolysis in elderly people after collapse. BMJ 1984; 288: 1877–1878. doi:10.1136/bmj.288.6434.1877
[4] Tinetti ME, Liu WL, Claus EB. Predictors and prognosis of inability to get up after falls among elderly persons. JAMA 1993; 269: 65–70
[5] Cuevas-Trisan R. Balance Problems and Fall Risks in the Elderly. Clin Geriatr Med 2019; 35: 173–183. doi:10.1016/j.cger.2019.01.008
[6] Gleich J, Fürmetz J, Kamla C, et al. Gluteales Kompartmentsyndrom nach Liegetrauma bei Opiatabusus. Unfallchirurg 2020; 123: 496–500. doi:10.1007/s00113-020-00792-9
[7] Fleming J, Brayne C, and the Cambridge City over-75s Cohort (CC75C) study collaboration. Inability to get up after falling, subsequent time on floor, and summoning help: prospective cohort study in people over 90. BMJ 2008; 337: a2227–a2227. doi:10.1136/bmj.a2227
[8] Wild D, Nayak USL, Isaacs B. How dangerous are falls in old people at home? Br Med J 1981; 266–268
[9] Bloch F. CRITICAL FALLS: WHY REMAINING ON THE GROUND AFTER A FALL CAN BE DANGEROUS, WHATEVER THE FALL. J Am Geratrics Soc 2012; 60: 1375–1376. doi:https://doi.org/10.1111/jgs.13910
[10] Ahmed N, Greenberg P. Early risk stratification of in hospital mortality following a ground level fall in geriatric patients with normal physiological parameters. Am J Emerg Med 2020; 38: 2531–2535. doi:10.1016/j.ajem.2019.12.031
[11] Millar WJ, Hill GB. Hip fractures: mortality, morbidity and surgical treatment. Health Rep 1994; 6: 323–337
[12] Balvers K, Van Der Horst M, Graumans M, et al. Hypothermia as a predictor for mortality in trauma patients at admittance to the intensive care unit. J Emerg Trauma Shock 2016; 9: 97. doi:10.4103/0974-2700.185276
[13] Chou S-E, Rau C-S, Tsai Y-C, et al. Risk factors and complications contributing to mortality in elderly patients with fall-induced femoral fracture: A cross-sectional analysis based on trauma registry data of 2,407 patients. Int J Surg 2019; 66: 48–52. doi:10.1016/j.ijsu.2019.04.010
[14] Abdel-Rahman EM, Turgut F, Turkmen K, et al. Falls in elderly hemodialysis patients. QJM 2011; 104: 829–838. doi:10.1093/qjmed/hcr108
[15] Padrón-Monedero A, Damián J, Pilar Martin M, et al. Mortality trends for accidental falls in older people in Spain, 2000-2015. BMC Geriatr 2017; 17: 276. doi:10.1186/s12877-017-0670-6
[16] Deutsche Gesellschaft für Unfallchirurgie e.V. S3-Leitlinie – Polytrauma / Schwerverletzten-Behandlung (AWMF Registernummer 187-023). AWMF 2022;
[17] Gaik C. Rhabdomyolyse. Ein Überblick zu Pathophysiologie, Diagnostik und Therapie. Gaik C Wiesmann T Rhabdomyolyse Ein Überbl Zu Pathophysiol Diagn Ther 2020; 302–319. doi:10.19224/ai2020.302
[18] Paal P, Brugger H, Strapazzon G. Accidental hypothermia. In: Handbook of Clinical Neurology. Elsevier; 2018: 547–563
[19] Snijders BMG, Roos MJ, Keijsers CJPW. Incidences of underlying causes of hypothermia in older patients in the emergency department: a systematic review. Eur Geriatr Med 2023; 14: 411–420. doi:10.1007/s41999-023-00791-0
[20] Rauch S, Brugger H, Paal P. Akzidentelle Hypothermie: ein Update. Notfallmedizin Up2date 2018; 13: 431–444. doi:10.1055/a-0587-9463
[21] Brugger H, Putzer G, Paal P. Akzidentelle Hypothermie. Anaesthesist 2013; 62: 624–631. doi:10.1007/s00101-013-2205-7
[22] Junttila MJ, Sager SJ, Tikkanen JT, et al. Clinical significance of variants of J-points and J-waves: early repolarization patterns and risk. Eur Heart J 2012; 33: 2639–2643. doi:10.1093/eurheartj/ehs110
[23] Gussak I, Brugada P, Brugada J, et al. Idiopathic Short QT Interval:A New Clinical Syndrome? Cardiology 2000; 94: 99–102. doi:10.1159/000047299
[24] Chhabra L, Devadoss R, Liti B, et al. Electrocardiographic Changes in Hypothermia: A Review. Ther Hypothermia Temp Manag 2013; 3: 54–62. doi:10.1089/ther.2013.0003
[25] Cadogan M, Buttner,Robert. Osborn Wave (J Wave). Life Fastlane – ECG Libr 2022; Im Internet: https://litfl.com/osborn-wave-j-wave-ecg-library/
[26] Ait-Oufella H, Lemoinne S, Boelle PY, et al. Mottling score predicts survival in septic shock. Intensive Care Med 2011; 37: 801–807. doi:10.1007/s00134-011-2163-y
[27] Dumas G, Lavillegrand J-R, Joffre J, et al. Mottling score is a strong predictor of 14-day mortality in septic patients whatever vasopressor doses and other tissue perfusion parameters. Crit Care 2019; 23: 211. doi:10.1186/s13054-019-2496-4
[28] Ferraris A, Bouisse C, Mottard N, et al. Mottling score and skin temperature in septic shock: Relation and impact on prognosis in ICU. PLOS ONE 2018; 13: e0202329. doi:10.1371/journal.pone.0202329
[29] Dow J, Giesbrecht GG, Danzl DF, et al. Wilderness Medical Society Clinical Practice Guidelines for the Out-of-Hospital Evaluation and Treatment of Accidental Hypothermia: 2019 Update. Wilderness Environ Med 2019; 30: S47–S69. doi:10.1016/j.wem.2019.10.002
[30] Bjertnæs LJ, Næsheim TO, Reierth E, et al. Physiological Changes in Subjects Exposed to Accidental Hypothermia: An Update. Front Med 2022; 9: 824395. doi:10.3389/fmed.2022.824395
[31] Bernhard M, Kumle B, Dodt C, et al. Versorgung kritisch kranker, nicht-traumatologischer Patienten im Schockraum: Empfehlungen der Deutschen Gesellschaft für Interdisziplinäre Notfall- und Akutmedizin zur Strukturierung, Organisation und Ausstattung sowie Förderung von Qualität, Dokumentation und Sicherheit in der Versorgung kritisch kranker, nicht-traumatologischer Patienten im Schockraum in der Bundesrepublik Deutschland. Notf Rettungsmedizin 2022; 25: 1–14. doi:10.1007/s10049-022-00997-y

