Teil I : Das akute B-Problem – Frau Dokta, keine Luft!
Fallbeispiel : Es ist dein erster Nachtdienst in der Notaufnahme. Du hast dir gerade einen Kaffee gemacht, denn alles schien ruhig. Böser Fehler! Aus deinem Arztzimmer hörst du das vertraute Düdelüt düdüt eines unzufriedenen Rettungsdienstmonitors. Das konnte nur Ärger bedeuten. Der Ärger kam in Form von Frau Brömmelkamp.
Frau Brömmelkamp ist eine 75jährige nette alte Dame, allein lebend, mit 2 Seiten Vorerkrankungen und einem noch längeren Medikamentenplan. Der Notfallsanitäter berichtet dir, dass sie gerufen wurden, weil Frau Brömmelkamp keine Luft mehr bekommen hätte. Deine Notfallpflege schiebt während der Übergabe das Rettungsteam mitsamt der Patientin unauffällig in einen Schockraum.
Der Monitor trötet erneut lautstark seinen Unmut über die Vitalwerte der Patientin hinaus. SpO2 90%, nicht so schlimm denkst du. Blutdruck 190/105mmHg. Ja und? Herzfrequenz 105/min, regelmäßig. Ein ungutes Gefühl beschleicht dich. Dein Blick fällt auf die im Bett sitzende, gestresst atmende Patientin. Atemfrequenz 30/min. Sauerstoffmaske über der Nase. 15l O2/min. Die Patientin presst nur ein „Frau Dokta, keine Luft.“ über die Lippen. Oh shit. Du ziehst dein Diensttelefon aus der Tasche
Treat first, what kills first!
Jeder von uns steht bei seinem ersten respiratorisch crashenden Patienten erst einmal hilflos daneben, weiss um das Risiko für den Patienten, hat aber nicht das Mind- und Toolset um der vitalen Bedrohung zu begegnen und Zeit für weitere Diagnostik und Therapie zu erkaufen. Diese Artikelreihe soll dir dabei helfen Patienten mit B Problem zu identifizieren und eine adäquate Initialtherapie mit nichtinvasiver Beatmung einzuleiten.
Im ersten Teil der Artikelreihe lernst du das B-Problem sicher zu identifizieren.
- Teil I : Das akute B-Problem – Frau Dokta, keine Luft!
- Was ist ein B-Problem?
- Wie erkenne ich ein B-Problem?
- tl,dnr oder die Zusammenfassung
- Literaturverzeichnis
Was ist ein B-Problem?
Das (x)ABCDE Schema ist eine Möglichkeit um bei kritisch kranken Patienten kein vital bedrohliches Problem eines Organsystems zu übersehen indem man es systematisch abarbeitet. A(irway) und B(reathing) stellen hier neben C(irculation) die dringlichsten Notfälle dar, an denen unser:e Patient:in unbehandelt rasch versterben kann.
Wogegen A(irway) sich mit der Kompetenz des Atemweges ( Verlegung, Schwellung, Verletzung ) beschäftigt, ist das akute B(reathing) Problem eher mit dem Problem der Atemmechanik und/oder des Gasaustausches beschäftigt.
Das B- Problem stellt mit einer Häufigkeit von 26-28% der nicht-traumatologischen Schockraumpatienten die häufigste Entität unter den kritischen Patienten dar. Daher lohnt es sich hier eine gewisse Kompetenz zu entwickeln.[1]
Gasaustauschstörungen
Bei Gasaustauschstörungen ist vor allem die Fähigkeit Sauerstoff ins Blut aufzunehmen beeinträchtigt. Hieraus resultiert eine Hypoxämie, d.h. ein erniedrigter Sauerstoffgehalt im Blut. Dies passiert z.B. beim Pneumothorax, der Lungenembolie, Pneumonie oder dem Lungenödem. Diese resultieren aus einem verlängerten Diffusionsweg (z.B. Ödembildung) oder einer Shuntbildung die Blut an mit Sauerstoff gefüllten Lungenanteilen (z.B. Atelektasen, ARDS etc.) vorbei leitet.
MERKE Gasaustauschstörungen lassen sich durch eine Erhöhung der Sauerstoffzufuhr i.e. fiO2↑ oder einer Vergrößerung der durchbluteten Gasaustauschfläche der Lunge i.e. PEEP im Bereich der optimalen Vordehnung der Lunge, beeinflussen.
Ventilationsstörungen
Bei Ventilationsstörungen ist die Fähigkeit der ausreichenden Ventilation von belüfteten Lungenarealen eingeschränkt. Hierunter leidet vor allem die Abatmung von CO2. Es entsteht eine Hyperkapnie, das heißt ein erhöhter Kohlenstoffdioxidpartialdruck im Blut. Dies tritt vor allem bei der exazerbierten COPD oder dem Asthma bronchiale auf. Zudem kann es bei allen Erkrankungen auftreten, die mit einer erhöhten Atemarbeit einhergehen ( z.B. neuromuskuläre Erkrankungen, Hyperventilation bei Gasaustauschstörungen mit konsekutiver Erschöpfung der Atemmuskulatur, aber ebenso bei Rippenserienfrakturen, Intoxikationen (z.B. Opioide) oder metabolischer Azidose(z.B. bei Sepsis, akutem Nierenversagen, ..))
MERKE Ventilationsstörungen lassen sich durch eine Reduktion der Atemarbeit beeinflussen, d.h. die Lunge befindet sich im optimalen Bereich der Ruhedehnungskurve (PEEP) – dadurch wird die Atemarbeit reduziert. Zudem lässt sich durch eine Überdruckbeatmung die Muskelarbeit reduzieren. Eine Optimierung des Atemwegswiderstandes (Resistance) durch Gabe von Bronchodilatatoren oder Entfernung von Sekreten kann ebenfalls die Atemarbeit massiv (positiv) beeinflussen.
Wie erkenne ich ein B-Problem?
Körperliche Untersuchung – Wenn du hier aufpasst, kannst du Leben retten!
Die klinische Untersuchung ist das Herzstück der Identifizierung eines B-Problems. Wenn ihr folgende Zeichen beachtet, wird es euch einfach fallen, den kritischen oder gefährdeten Patienten mit Luftnot von dem Patienten ohne akute Gefährdung abzugrenzen und Weichen für eine weitere Therapie zu stellen. Die körperliche Untersuchung reicht um eine Indikation für NIV zu stellen – alle weiteren Maßnahmen sind nice to have und sollten die Indikationsstellung beim vital gefährdeten Patienten nicht verzögern – auch wenn sie weitere Anpassungen in der Therapie des zugrundeliegenden Problems triggern.
CAVE keine der nachgenannten Veränderungen steht für sich allein – wichtig ist es diese miteinander in Beziehung zu setzen. Die Spezifität der Zeichen zur Identifizierung eines akuten B-Problems erhöht sich mit der Anzahl der Zeichen.
Atemfrequenz [2,3]
Die Atemfrequenz wird präklinisch und klinisch immer stiefmütterlich behandelt. Dabei stellt sie bei einem akuten B-Problem eine wertvolle Information dar.
Die normale Atemfrequenz beträgt 10-18/min. Eine Atemfrequenz <8-10 oder >25 sind deutliche Hinweise auf ein respiratorisches Problem und bedürfen eines genaueren Hinsehens und der Korrelation mit dem weiteren Erscheinungsbild des Patienten.
Eine tiefe Atemfrequenz kann gemeinsam mit einer Bewusstseinsstörung der Hinweis auf eine Intoxikation ( z.b. sedierende Medikamente wie Opioide ), eine Hyperkapnie oder eine zentrale Atemstörung sein. Hier kann die Beurteilung des neurologischen Status (z.B. Pupillendifferenz, Miosis, Paresen) hilfreich sein für das weitere Vorgehen.
Eine hohe Atemfrequenz kann auf eine Oxygenierungs- oder Decarboxylierungsstörung hindeuten. Diese kann im Rahmen z.B. einer Pneumonie oder einer exacerbierten COPD auftreten. Hier hilft die weitere in Augenscheinnahme des Patienten. Gibt es Zeichen einer Zyanose? Wie ist die Atemdynamik? Kann der Patient ganze Sätze sprechen? Gibt es Zeichen einer Infektion? Eine Steigerung der Atemfrequenz korreliert bei der ambulant erworbenen Pneumonie mit der Mortalität.[4]Bei einer Atemfrequenz >20/min und <30/min mit 1,7% Mortalität, bei einer Atemfrequenz zwischen 30 und 40/min auf 9% und größer 40/min bei 16%.[5] Daher ist eine Hyperventilation immer verdächtig auf ein akutes B- Problem.
Leider ist eine Hyperventilation alleine gesehen kein Zeichen für eine respiratorische Einschränkung. Eine psychogene Hyperventilation ist für den Notfallmediziner nicht immer sicher von einem akuten B Problem abzugrenzen. Psychischer Erregungszustand, Pfötchenstellung und eine Übererregbarkeit von Nerven und Muskeln (z.B. Chvostek Zeichen : Beklopfen der Wange 1-2cm vor dem Ohrläppchen. Eine Muskelreaktion führt zu einem positiven Test).
Eine ausreichende Differenzierung ob die Hyperventilation Ausdruck einer organischen Störung ist, ist mit einer Blutgasanalyse möglich.
Moderne Patientenmonitore können über Impedanzpneumographie (EKG)[6] oder Photoplethysmographie (spO2 Sensor) die Atemfrequenz ermitteln. Beide Methoden sind anfällig für Störungen der zugrundeliegenden Messtechnik. Daher ist im Zweifel die sicherste Variante das manuelle Auszählen der Atemfrequenz.Am einfachsten macht ihr euch das zählen über eine Zeit von 15s und multipliziert mit 4 um auf eine Atemfrequenz zu kommen.
Atmungsmechanik [2]
Bei der Atmungsmechanik betrachten wir wie tief ein Patient einatmet und ob er Atemhilfsmuskulatur gebraucht.
Eine flache Atmung bei Hyperventilation kann ein Zeichen auf eine Pneumonie, Pleuraergüsse oder eine anderweitig eingeschränkte Gasaustauschfläche ( z.B. Distension des Abdomens bei Ileus, massiver Aszites bei Leberzirrhose ) sein. Der Patient versucht eine flache Atmung mit Hyperventilation auszugleichen, kommt aber leider darüber in eine Spirale die irgendwann zur respiratorischen Erschöpfung führt, da die Atemfrequenz durch Steigerung der Totraumventilation nicht beliebig steigerbar ist. Irgendwann überwiegt die Totraumventilation die Ventilation am Gasaustausch teilnehmender Bereiche und es kommt zu einer Hyperkapnie.
MERKE Ein flach atmender, hyperventilierender Patient der seine Atemhilfsmuskulatur einsetzt (“der pumpt ganz schön”) ist bis zum Beweis des Gegenteils akut vital gefährdet! Der kann nicht warten!
Sprechdyspnoe
CAVE Wenn dein Patient nur noch Worte, anstatt ganzer Sätze herausbekommt, dann weisst du ist es höchste Eisenbahn – dieser Patient hat eine hochgradige Kompromittierung der Atmung und damit ein B- Problem!
Bei bekanntem Asthma bronchiale spricht eine Sprechdyspnoe für einen schweren Asthmaanfall – hier gilt je kürzer die Sätze, desto schwerwiegender Anfall.
Jedoch ist die Datenlage hier uneinheitlich wann eine schwere respiratorische Beeinträchtigung beginnt ( 4-6 Worte oder <4 Worte ).[2]
Lippenzyanose/Zyanose der Akren [7]
Bei einem Lungengesunden Patienten kann die Zyanose der Lippen und der Akren (v.a. Nagelbetten) ein guter klinischer Hinweis auf eine Hypoxämie sein. Diese wird ab 3g desoxgeniertem Hämoglobin pro 100ml arteriellem Blut (≙1.86mmol/l; spO2 <80%) sichtbar. Bei Zentralisierung des Kreislaufs zeigt sich die Hypoxämie erst peripher an den Akren – bei ausgeprägtem Oxygenierungsproblem auch an den Lippen, den Mundschleimhäuten und der Zunge.
CAVE Hier gibt es ein paar Fallstricke :
Patienten mit chronischer Hypoxämie zeigen in aller Regel eine zentrale Zyanose, welche sich z.B. bei COPD Patienten nicht mit der peripheren Sauerstoffsättigung übereinbringen lässt und teilweise noch unter Sauerstoffgabe persistiert. Dies liegt daran, dass Patienten mit chronischer Hypoxämie zu einer vermehrten Bildung von Erythrozyten neigen (Polyglobulie) um mehr potentielle Sauerstoffträger zur Verfügung zu haben. Trotz einer peripheren Sauerstoffsättigung von >90% wird bei >3g desoxgeniertem Hämoglobin/100ml arterialisiertem Blut eine zentrale Zyanose sichtbar. Dies liegt daran dass diese 3g(≙1.86mmol/l) eine geringere Fraktion des gesamten Hämoglobin (beim COPD Patienten Hb 17-18g/dl ≙ 10,55 – 11,17 mmol/l) als beim Lungengesunden (Hb 12-14g/dl ≙ 7,45 – 8,69 mol/l) sind und trotz ausreichender Sättigung des Hämoglobins eine Zyanose auftritt.
Eine Methämoglobinämie kann ab einem Gehalt von 10% MetHb und größer im arterialisiertem Blut eine Zyanose imitieren. Eine spO2 Messung kann hier ebenfalls aufgrund ähnlicher Absorptionsspektren zu desoxygeniertem Hämoglobin in die irre geführt werden. Das Blut hat bei Abnahme eine schokoladenbraune Farbe. Verlässlich ist hier nur eine Blutgasanalyse mit Oxymetrie um desoxyHb und metHb auseinanderzuhalten.
Schöner Artikel bei den ToxDocs zur Therapie der Methämoglobinämie
Bewusstseinsstörung [2]
Für eine Bewusstseinsstörung im Rahmen der Atmung kommen Störungen des Gasaustausches oder der Atemmechanik als Ursache in Frage :
Hyperkapnie
Eine akute Hyperkapnie kann zu einer sogenannten CO2 Narkose führen. Dies bedeutet, wenn die Atemmechanik nicht mehr das Atemminutenvolumen, was zum Abatmen der produzierten Menge CO2 ausreicht, erreichen kann, akkumuliert sich CO2 im Blut und der Partialdruck steigt. Normal liegt der CO2 Partialdruck im Blut bei 32-45mmHg (4,2-5,8kPA). Er ist in diesen Grenzen eng reguliert und ein Anstieg führt zu einem vermehrten Atemantrieb und damit zu einer tieferen und schnelleren Atmung um das Atemminutenvolumen zu steigern. Reicht dies nicht aus steigt der CO2 Partialdruck weiter und führt zu einer zunehmenden Bewusstseinstrübung. Dies kann beim nicht chronisch Lungenkranken schon ab 60-70mmHg (7,8-9,1kPA) der Fall sein. Patienten mit einer chronischen Lungenerkrankung können an eine chronische Hyperkapnie adaptiert sein ( der Blut-PH ist hier oft nahe am Normalbereich ) und erst bei deutlich höheren Werten eine Bewusstseinstrübung erleiden.
Bei Intoxikationen mit einer begleitenden Hypoventilation kann eine Hyperkapnie die Bewusstseinsstörung verstärken.
Hypoxämie
Als Ursache der Unterversorgung des Blutes und damit der Gewebe mit Sauerstoff kann meist eine Gasaustauschstörung identifiziert werden (hypoxäme Hypoxie).
Eine Hypoxämie zeigt sich schleichend mit einem Gefühl der Dyspnoe, Kurzatmigkeit und einer zunehmend geringeren Belastbarkeit. Die Herzfrequenz steigt an und es kommt zu Kopfschmerzen. Dann kommt eine Verwirrung hinzu bis zur Bewusstseinstrübung, welche mit fallendem Sauerstoffpartialdruck immer tiefer wird. Bei kritischer Sauerstoffversorgung kann es zu Krampfanfällen kommen.
Ab einer spO2 von 50% (27mmHg/3,5kPa) ist der nicht an Hypoxämie gewöhnte Patient meist bewusstseinsgetrübt. Ein chronisch hypoxämer Patient reagiert mit der Bildung von mehr Erythrozyten ( Polyglobulie) – hier kann der Patient auch unter diesen Werten noch wach und kommunikationsfähig sein.
Eine reine Hypoxämie ohne Störungen der Atemmechanik führt nur kurzfristig ab einer paO2 von 50-60mmHg zur Hyperventilation, wobei eine gleichzeitige Hyperkapnie die Atemantwort auf eine arterielle Hypoxämie deutlich verstärkt.
Trommelschlegelfinger und Uhrglasnägel
Diese Anomalien der Finger werden in ca. 80% der Fälle durch eine Atemwegerkrankung verursacht. Man vermutet dass Trommelschlegelfinger durch eine systemweite Hypoxämie und die hieraus resultierende Neubildung von Kapillarbetten entstehen. Die Hypoxämie beeinflusst ebenfalls das Nagelwachstum, so dass sich dystrophe Nagelwuchsstörungen mit der typischen Form eines Uhrglases manifestieren.
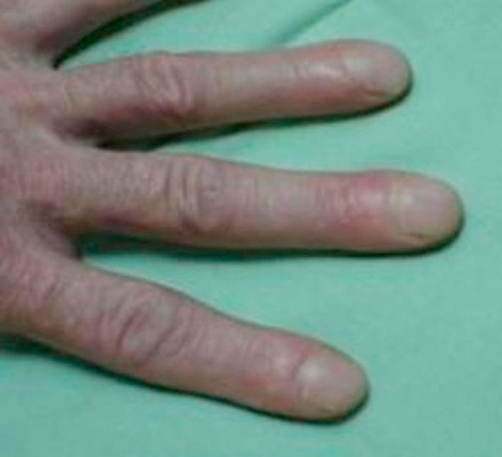
Hiervon abzugrenzen ist die Hypertrophe pulmonale Osteoarthropathie (HPOA, Marie-Bamberger Syndrom), welche häufig als Paraneoplasie eines Lungenkarzinoms auftritt. Hier zeigt sich neben den Erscheinungen an den Fingern auch Symptome der kleinen Gelenke im Sinne einer Osteoarthritis. Entstehung der Trommelschlegelfinger und Uhrglasnägel ist hier ebenfalls durch Ausschüttung von VEGF ( vascular endothelial growth factor) im Rahmen der systemischen Hypoxämie.[8]
MERKE Trommelschlägelfinger und Uhrglasnägel sind immer nur Hinweise auf eine chronische Lungenerkrankung, im akuten Setting machen sie es einfacher eine Exazerbation der bekannten Grunderkrankung anzunehmen. Bitte denkt hier auch immer an die Differentialdiagnosen!
Auskultation
Lungengeräusche und deren Auskultation waren so etwas wie der heilige Gral der Inneren Medizin. Die Erfindung des Horchrohrs durch Rene Laennec im Jahre 1816 machte die Auskultation zur vierten Säule der medizinischen körperlichen Untersuchung.[12]
Die Auskultation ist vergleichbar mit dem horchen an einem Schlüsselloch, was wir als Kinder gerne taten – man bekommt etwas mit, nicht alles und das was man versteht ist für viele Interpretationen offen. Es ist ein Anhalt, dass sich dort etwas tut. Was, das bleibt meist der Interpretation des Untersuchers überlassen.
Vesikuläres Atemgeräusch beidseits, seitengleich, ohne Rasselgeräusche und Nebengeräusche wäre ein Normalbefund. Formal auskultiert man dafür den Patienten von 3 Seiten. Jetzt ist die Frage ob dies bei einem atemnötigen, agitierten Patienten, der zudem hyperventiliert so viel Informationen liefert. Ich mit meiner beginnenden Schwerhörigkeit muss sagen – eher nicht.
Sicher kann ein abgeschwächtes Atemgeräusch einen Hinweis auf einen Pneumothorax oder einen Pleuraerguss liefern – was es von beidem definitiv ist, lässt sich jedoch nicht sicher unterscheiden.
Eine endexspiratorische Spastik – ist es jetzt die exazerbierte COPD oder das Lungenödem? Wer das bei unseren heutigen Patienten die oft eine COPD und eine Herzinsuffizienz gleichzeitig haben unterscheiden kann – Chapeau!
Gleiches gilt für die Differenzierung Infiltrat oder Atelektase?
Einzig der inspiratorische Stridor weist sicher auf einen komprommitierten Atemweg hin – und hier ist akuter Handlungsbedarf – wogegen bei den anderen Auskultationsbefunden oft Zeit für weitere Diagnostik ist.
MERKE Auskultation ist oft eher Show für den Patienten, als dass sie einen wirklich relevanten diagnostischen Nutzen in der Notfallsituation hat.
Inspektion der Halsvenenfüllung
Übermäßig gefüllte Halsvenen in 30-45° Oberkörperhochlagerung können auf ein Abstromhindernis der großen Venen hindeuten. Dies kann durch ein akutes (z.B. bei Rechtsherzinfarkt oder Lungenarterienembolie) oder chronisches Rechtsherzversagen ( dann meist in Kombination mit einem Linksherzversagen), ein Rückwärtsversagen ( z.B. große Mitralklappeninsuffizienz mit Rückstauung ) oder eine Obstruktion durch eine große Raumforderung bedingt sein. Ein weiterer Puzzlestein mit einem Blick.
Monitoring – darf’s noch ein bisschen mehr sein?

Was wäre die Notfallmedizin / Anästhesiologie / Intensivmedizin ohne ihr apparatives Basismonitoring? – nicht viel anders. Meine ketzerische These ist – wir kommen auch erst einmal für eine gewisse Zeit ohne sie aus und die schönen shiny Werte auf dem Monitor können einen auch ganz schön in die Irre führen. Wer viel misst, misst viel Mist.
MERKE Der klinische Blick sollte euch immer leiten und wenn er nicht zu dem passt was auf dem Monitor steht, solltet ihr die Werte hinterfragen – stimmt das was da steht? Wie passt das zum Eindruck meines Patienten?
periphere Sauerstoffsättigung (spO2) [9]
Was tut das Licht? Es leuchtet rot!
Die periphere Sauerstoffsättigung wird mittels Pulsoxymetrie im kapillären Blut der Finger oder Akren (Nase,Ohrläppchen) bestimmt. Das Pulsoxymeter bestimmt durch Dioden welche Licht von 660nm (rot, desoxygeniertes Hb) und 905-920nm (infrarot, oxygeniertes Hb) ausstrahlen und durch das Gewebe auf einen Sensor fallen die Sättigung des Hämoglobins mit Sauerstoff. Normwerte sind zwischen 95 und 100% und werden am besten bei intakter peripherer Durchblutung abgeleitet. Zudem lässt sich hiermit die periphere Pulsfrequenz bestimmen.
CAVE Einschränkungen der Pulsoxymetrie bestehen wie gesagt bei Zentralisierung bei Schock oder Hypothermie, Nagellack oder künstliche Fingernägeln oder auch Methämoglobinämie (spO2 hier eher um die 85% ) oder CO-Hb (spO2 hier um die 100 % bei massiver Luftnot) . Bewegungen (Tremor, Kopfsteinpflaster im RTW) können eine Messung unmöglich machen.
MERKE bei guter peripherer Durchblutung ein wertvolles Tool, jedoch mit Limitationen – daher lohnt es sich mit der Technik auseinanderzusetzen. Es ist einfacher, nicht invasiv und schneller verfügbar als eine arterielle BGA und ein besseres Maß für die Gewebsversorgung mit Sauerstoff als dieselbe[10]. Absolutes Basismonitoring!
Weiterführende Infos :
Wikipedia Pulsoxymetrie Artikel
Deranged Physiology – Principles of pulse oximetry
Artikel: A Jubran – Pulse oximetry
Blutgasanalyse (xBGA)
Die Blutgasanalyse ist ein wertvolles point of care tool um Störungen der Atmung zu differenzieren. Sie kann zwischen akuten und chronischen Störungen differenzieren, Hinweise geben ob eher eine Oxygenierungsstörung oder eine Ventilationsstörung vorliegt und ob schon eine Kompensation stattgefunden hat. Nebenbei ermöglicht die Oxymetrie auch eine Bestimmung von CO Hb oder metHb.
Eine ausführliche Besprechung der BGA und deren Auswertung würde in diesem Artikel zu weit führen. Daher gibt es hier ein paar Ressourcen die euch dabei helfen:
Nerfallmedizin – Blutgasanalyse BGA Basics
Life in the Fast Lane Acid-Base and Blood Gas interpretation .
EMCrit: Internet Book of Critical Care (IBCC ) – ABG, VBG, and pulse oximetry
PinUpDocs – Die Blutgasanalyse
venöse BGA (vBGA)
Wenn du eine BGA brauchst, dann ist es die venöse BGA. Sie ist schnell entnommen aus einem liegenden Zugang und gibt dir zu spO2 die Informationen die du wissen willst – ist der Patient hyperkapnisch? Hat er eine gestörte Ventilation? Die Werte die dich hier am meisten interessieren sind
- der pH : normal dümpelt der 7,35 und 7,45 herum. Bei einem pH darunter hast du eine Azidose, ein pH darüber eine Alkalose.
- der CO2 Partialdruck (pCO2) : bei gesunder Lunge und normaler Atmung ist dieser zwischen 35mmHg und 45 mmHg (4,6-5,9kPa). Hier gilt – je mehr Stoffwechsel, desto höher der pCO2, je weniger ausreichend die Ventilation, desto höher der pCO2.
Das pCO2 in der venösen BGA stimmt mit dem CO2 der arteriellen BGA grötenteils überein( ca.5mmHg Differenz ). [11]Wer es genauer will dem sei der Artikel von Farkas über die Korrektur, v.a. bei niedriger spO2, auf EMCrit ans Herz gelegt.
MERKE Grundsätzlich gilt : wer in der venösen BGA keine Hyperkapnie aufweist, weist diese in der arteriellen BGA ebenfalls nicht auf.
- das Bicarbonat (HCO3) : Normwerte hier zwischen 22 und 26mmol/l. Es lässt sich durch Atmung beeinflussen – weniger als der Normwert bedeutet einen Verlust – z.B. durch Hyperventilation. Mehr bedeutet entweder Retention ( n. Ausreichende Ventilation) oder Kompensation durch die Niere.
Keiner der oben genannten Werte lässt sich alleine beurteilen.
Azidose, Hyperkapnie und normwertiges bis erhöhtes HCO3 spricht für eine respiratorische Azidose bei Ventilationsstörung.
spO2 niedrig, Alkalose bis Normbefund, pCO2 niedrig, HCO3 niedrig eher für eine respiratorische Alkalose Z.B. im Rahmen einer Hyperventilation bei Oxygenierungsstörung.
Für die Beurteilung gibt es eine schöne Grafik auf NERDfallmedizin : Blutgasanalyse BGA Basics
Insgesamt ist es ein weiterer Baustein in der Diagnostik eines akuten B- Problems. Sie dient um euren klinischen Eindruck in die richtige Richtung zu schieben und zudem könnt ihr hiermit die Parameter eurer Beatmung optimieren.
emDocs – ABG vs VBG in the Emergency departement
kapilläre/arterielle BGA (kBGA/aBGA)
Die kapilläre und arterielle BGA haben neben höherem personellen und materialtechnischen Aufwand den Nachteil dass sie im Fall der arteriellen BGA einer arterielle Punktion bedürfen. Wenn ihr auf jeden Fall für euer hämodynamisches Monitoring eine arterielle Blutdruckmessung legen wollt, könnt ihr diese nutzen. Leider ist die Expertise hierfür öfters auf ärztlicher als auf pflegerischer Seite anzutreffen – wobei diese trotz Expertise oftmals im Notfall auch schwierig zu etablieren sein können.
Die kapilläre BGA zeigt zudem oft verfälschte Werte der spO2 und des Sauerstoffpartialdrucks bei Zentralisation und hoher Gewebssauerstoffauschöpfung. Sie hat für mich ein bisschen was von gewollt aber nicht gekonnt. Sie wird meist von Pneumologen gefordert. Der Nutzen ist in der Notfallmedizin eher überschaubar.
Merke Insgesamt übersteigt der Nutzen von kapBGA/aBGA bei konsequenter Nutzung von vBGA und spO2 im notfallmedizinischen Setting nicht den potentiellen Schaden (z.B Nervenverletzungen, Hämatome, Dissektion) – also überlasst diese Spielereien den Intensivmedizinern und Pneumologen. Es bindet nur Personal und Ressourcen die ihr in der Notaufnahme nicht in dem Maße verfügbar habt.
Oxymetrie in der BGA
Die Oxymetrie im BGA Gerät ermöglicht Dyshämoglobine wie CO Hb und metHB als Fraktion des vorliegenden Hämoglobins zu messen. Zudem lässt sich die Sättigung des Hämoglobins mit Sauerstoff direkt bestimmen.
Nützlich v.a. weil du auf einen Blick Ursachen einer Gewebshypoxämie vom Tisch hast.
point of care Ultraschall (POCUS) – Wie du deine Patienten durch Informationsvorsprung rettest!
Immer kleinere und portablere Ultraschallgeräte ermöglichten in den letzten Jahren, dass Patienten für eine Diagnostik nicht mehr zum Gerät gebracht werden mussten, sondern das Gerät und der Untersucher zu ihnen kam. Dies löste eine Revolution in der bettseitigen Notfalldiagnostik aus. Schnell, ohne ionisierende Strahlung und leicht zu erlernen ist der POCUS mittlerweile ein essentieller Baustein der Notfalldiagnostik im Rahmen von akuten B und C Problemen.[12] Viele Fragestellungen lassen sich mittlerweile in einem Untersuchungsgang lösen und ermöglichen eine zielgerichtetere Diagnostik und vor allem Therapie. Protokolle wie RUSH oder eFAST ermöglichen neben der koordinierten Diagnostik des Schocks, auch die gleichzeitige Mitbeurteilung der Lunge. Alleinig ausgerichtet auf die Diagnostik der Lunge ist das BLUE ( Bed Lung Ultrasound in Emergency) Protocol.
Video: 5min Sono – Rush Exam
Video: 5min Sono – eFAST
Video: MetroHealth Emergency Ultrasound – The BLUE Protocol
Nysora: Acute respiratory failure : The BLUE Protocol
Artikel: D.A. Liechtenstein et al.- Relevance of Lung Ultrasound in the Diagnosis of Acute Respiratory Failure-The BLUE Protocol
Focused Acute Medicine Ultrasound (FAMUS) – BLUE protocol
Pneumothorax – ist die Lunge kollabiert?
Der Pneumothorax ist ein Klassiker unter den Ursachen des akuten B-Problems. Mit Spannungskomponente wird er schnell lebensbedrohlich und kann unbehandelt rasch zum Kreislaufversagen und Tod führen. Sonographie kann hier schnell und akkurat zur Diagnose führen und die notwendige Entlastung beschleunigen.
Normal siehst du im Lungenultraschall nach BLUE Protokoll das sogenannte Fledermauszeichen mit Pleuragleiten und im M-Modus das sogenannte Seashore sign. Wenn du jetzt noch einen Lungenpuls im M-Modus siehst, dann hast du an der untersuchten Stelle keine Luft zwischen Pleura viszeralis und parietalis. Die Diagnostik erfolgt am höchsten Punkt immer bilateral im Verlgeich.
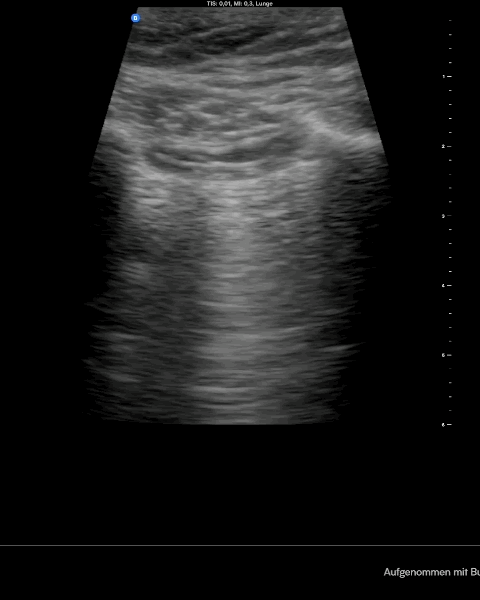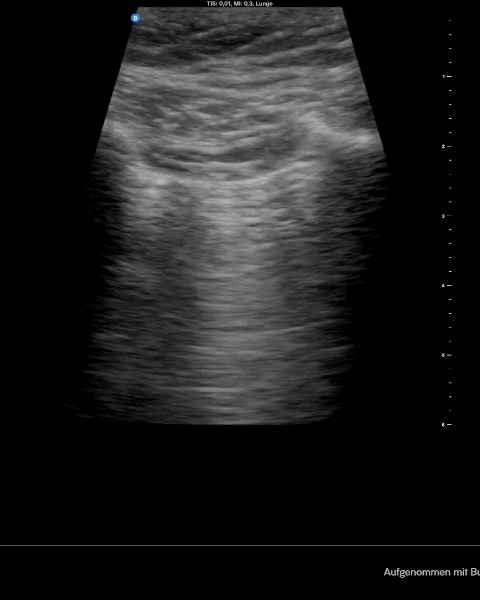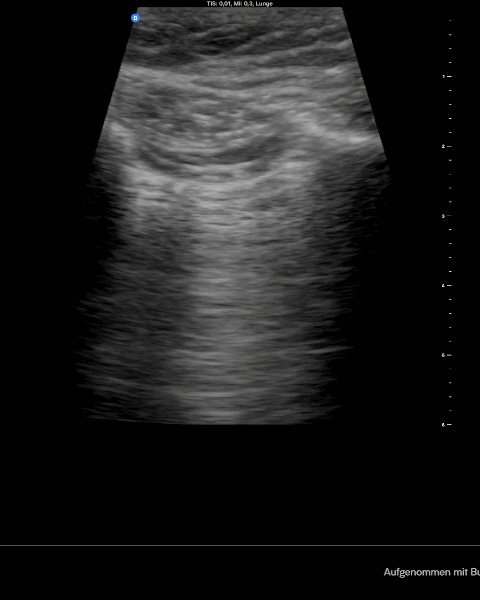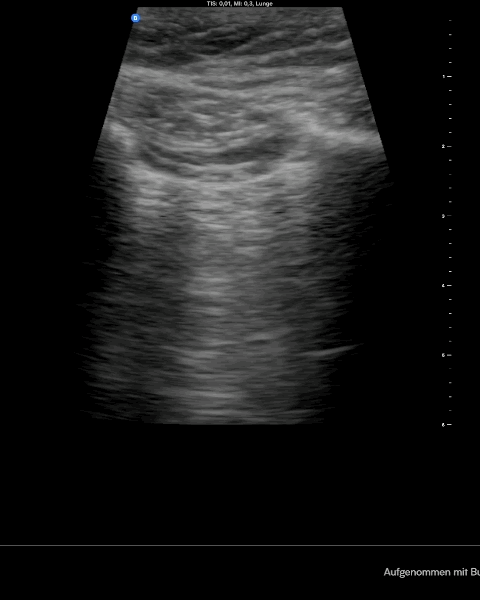
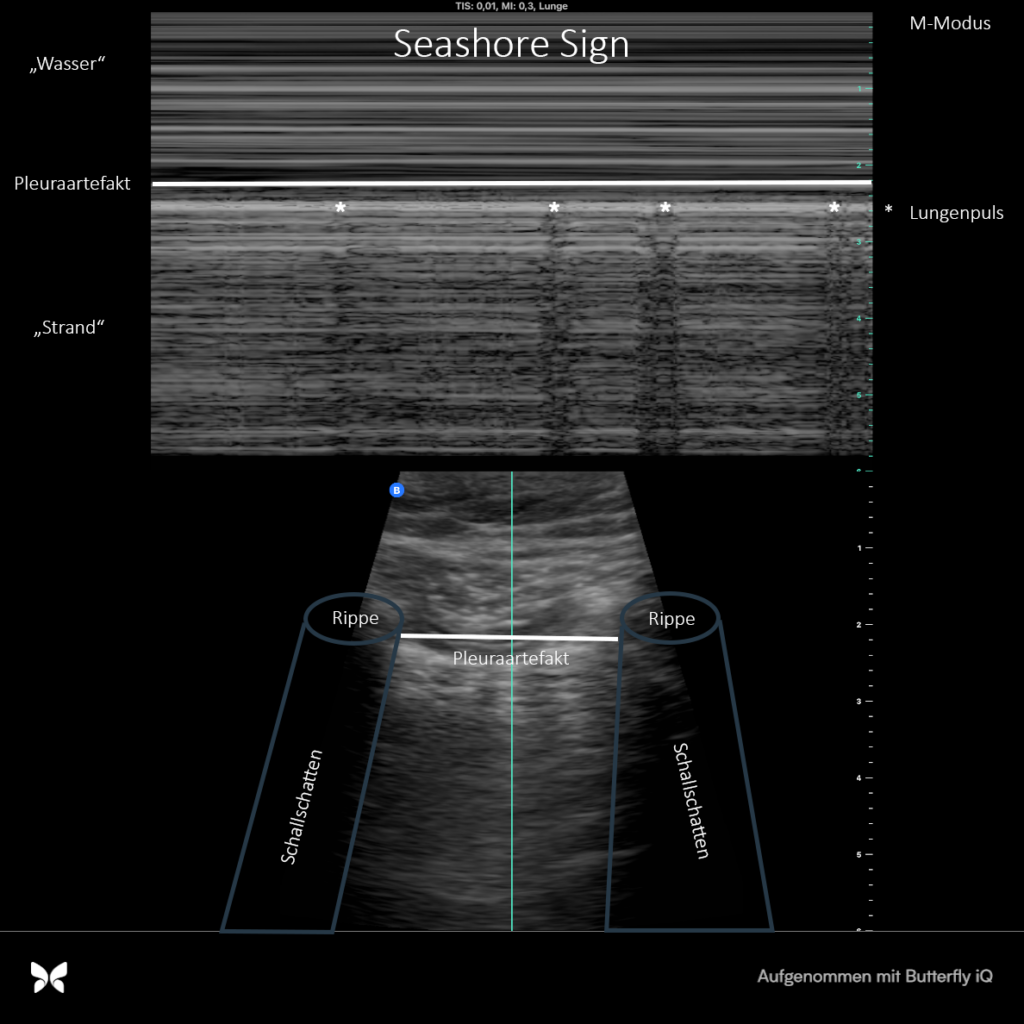
Merke: Einen Pneumothorax erkennst du in der Sonographie am aufgehobenen Pleuragleiten, am sogenannten Barcode Zeichen im M- Modus und am fehlenden Lungenpuls. Wenn du dann den Punkt findest wo sich Normalbefund und typische Zeichen eines Pneumothorax abwechseln hast du den endgültigen Beweis gefunden – den Lungenpunkt.
Unten findest du zwei gute Videos wie du einen Pneumothorax diagnostizierst. Wenn hierzu noch eine Kreislaufinstabilität mit Hypotonie kommt wird es höchste Eisenbahn diesen zu entlasten. Weitere Diagnostik ist dann nicht indiziert.
Anbei findet ihr zwei Videos die die Diagnostik eines Pneumothorax im Ultraschall demonstrieren.
Video: 5min Sono – Pneumothorax : Wie diagnostiziere ich einen Pneumothorax mit Ultraschall
Video: Amr Elmoheen – Nachweis Pneumothorax : Lungenpunkt, Seashore und Barcode Sign
Pleuraerguss – ist die Lunge von aussen komprimiert?
Ein Pleuraerguss ist eine Flüssigkeitsansammlung im Pleuraspalt die die üblchen 8-15ml Gleitlagerflüssigkeit übertrifft. Sie können im Rahmen infektiöser, metabolischer, tumoröser oder kardiovaskulärer Erkrankungen entstehen und zu einer respiratorischen Kompromittierung führen. Das Röntgen ist hier weniger sensitiv als der bettseitige Lungenultraschall. Dieser kann Ergüsse ab 50ml nachweisen und oh Wunder – man kann diese auch unter Ultraschallführung punktieren!
Anbei zwei gute Videos zum Nachweis eines Pleuraergusses :
Video: 5min Sono Pleuraerguss Part 1
Video: 5min Sono Pleuraerguss Part 2
Lungenödem – ist das Interstitium abgesoffen?
Flüssigkeitsansammlungen im Interstitium lassen sich ebenfalls als sonographische Artefakte (sogenannte Kometenschweifartefakte ie. B-Linien) nachweisen. Wenn sich mehr als 4 B Linien pro Untersuchungsquadrant befinden, weist das auf mehr Flüssigkeit im Interstitium hin. Findet ihr die ubiquitär kann es auf ein Lungenödem hindeuten. Findet ihr es lokalisiert, kann es mit einer Pneumonie oder Atelektase einhergehen. Im ARDS findet ihr ebenfalls bilaterale B- Linien.
Anbei findet ihr ein Video, worauf ihr bei der Diagnostik von B- Linien achten müsst:
Video: 5min Sono – B-Lines
Infiltrate, Atelektasen oder was?
Für Fortgeschrittene ist die direkte Erkennung von Konsolidierungen und deren Zuordnung zu Infiltrat oder Atelektase. Die folgenden Videos helfen euch dabei :
Video: 5min Sono – Pneumonie
Video: TATDUS – Atelektase und Pleuraerguss
Video: 5min Sono – Lungenkontusion
Video : Westernsono – Konsolidierung – Atelektase oder Pneumonie?
Pleura – Mottenfraß und andere Kuriositäten
Diverse Erkrankungen können subpleurale Veränderungen mit sich bringen. Ob es Verdichtungen durch Pleuraschwielen einer Viruserkrankung sind oder mottenfraßartige Dreiecksartefakte die hochverdächtig auf kleine Lungeninfarkte im Rahmen einer Lungenembolie sind – hier findet ihr ein Video für die Nerds unter euch :
Video: 5min Sono – Lungenembolie – Lungenbefunde in der Sonographie
Echokardiographie – was macht die Pumpe?
Die Notfallechokardiographie ermöglicht die bettseitige Beurteilung der Herzperformance. In der Notfallmedizin interessieren uns primär keine fancy Messungen aus dem Echo – Labor – uns interessiert : Perikarderguss ja/nein? Pumpt der linke Ventrikel ja/nein? pumpt gut, mittel, schlecht? Zeigen sich Zeichen der akuten Rechtsherzbelastung ( D-Sign, Trikuspidalinsuffizienz? TAPSE <16mm?). Hat der Patient >4 B-Linien in allen Lungenfenstern? Existieren Pleuraergüsse? Wenn wir jetzt noch auf die Aorta schauen haben wir das RUSH Protokoll abgearbeitet…

Da all das den Rahmen des Artikels sprengt findet ihr hier unten ein Video von Core Ultrasound zum Thema Basic Cardiac Function:
Video: 5min Sono – Basic Cardiac Function
Perikardtamponade
Das Perikard ist ein mit geringer Flüssigkeit gefüllter Sack der das Herz umhüllt. Ein schneller Anstieg von Flüssigkeit im Perikardsack kann deutliche Atemnot durch Fesselung des Herzens mit sich bringen und im schlimmsten Fall vom Erguss zur Tamponade mutieren. Ein lebensbedrohlicher Notfall. Hier wird euch gezeigt wie ihr es diagnostiziert :
Video: 5min Sono : Perikarderguss
Video: 5min Sono – Perikardtamponade
Lungenembolie –
Die Lungenembolie ist eine weitere, nicht ganz so seltene Ursache der Luftnot. Auch diese könnt ihr mit etwas Übung im bettseitigen Ultraschall erkennen. Oder ihr macht euch Zeichen der Rechtsherzbelastung zu nutze um weitere Diagnostik ( CT Thorax mit KM ) oder Therapie einzuleiten. Hier findet ihr 2 gute Videos die euch erklären was ihr dafür tun müsst.
Video : 5min Sono – Basic right heart assessment
Video: 5 min Sono – 60/60 Sign for acute pulmonary embolism
Radiologische Diagnostik
Röntgen:
Die klassische Röntgenaufnahme des Thorax gehörte jahrelang zur Basisdiagnostik beim respiratorisch kompromittierten Patienten. Sie ist schnell, günstig und ketzterisch formuliert selten brauchbar. Meist sind unsere Patienten mit einem B Problem kaum in der Lage zu stehen, geschweige denn frei zu sitzen. Mehr als eine anterior-posterior Aufnahme im Liegen ist halt nicht drin und dort seht ihr wenn nur ausgeprägte Pathologien oder auch gar nichts, was am Ende eh eine differenziertere Bildgebung erfordert. Zur Kontrolle einer Prozedur, wie z.B. der Anlage einer Pleuradrainage ist der Röntgen Thorax jedoch weiterhin geeignet.
MERKE Der Röntgen Thorax ist im akuten, schweren B Problem nicht die Diagnostik der Wahl. Wenn der Ultraschall nicht weiterhilft oder ergänzt werden muss wählt doch einfach direkt das CT Thorax mit KM.
Computertomographie:
Im Gegensatz zur einfachen Röntgenaufnahme in 2 Ebenen erhaltet ihr Schnittbilder des Thorax, die euch genau die Lage und Größe der Pathologie zeigen und unter Gabe eines Kontrastmittels sogar die Gefäßdarstellung möglich ist – der Goldstandard beim Verdacht auf eine Lungenarterienembolie oder Aortendissektion.
MERKE Die CT Thorax mit KM ist in der Diagnostik einer Thoraxpathologie die eierlegende Wollmilchsau – hat aber eine nicht zu vernachlässigende Strahlenbelastung. Diese ist meines Erachtens beim akuten B-Problem durchaus gerechtfertigt – denn dies ist eine Notfallindikation. Auch die Laborwerte müsst ihr im Notfall nicht abwarten, denn der Nutzen überwiegt den Schaden.
tl,dnr oder die Zusammenfassung
Ein akutes B Problem ist eigentlich einfach zu erkennen wenn ihr wisst worauf ihr achten müsste. Hier helfen euch Atemfrequenz, Lippenzyanose, Sprechdyspnoe und weitere einfache Zeichen einen Patienten im akuten respiratorischen Distress zu erkennen und frühzeitig eine Therapie einzuleiten, die euch Zeit für weitere Diagnostik erkauft.
Apparatives Monitoring wie die Pulsoxymetrie und die venöse BGA helfen weiter das B Problem etwas einzugrenzen. Bettseitiger Ultraschall hat in der Diagnostik wohl den größten Impact auf die weitere Therapie eures Patienten. Vergeudet nicht Zeit und Ressourcen mit Schrotschussdiagnostik, sondern führt eine adäquate und sinnvolle Diagnostik durch um die Zeit bis zur Therapie eures Patienten massiv zu verkürzen und ihm das Leben zu retten.
Literaturverzeichnis
[1] Kumle B, Michael M, Wermke A, et al. „B-Probleme“ des nichttraumatologischen Schockraummanagements. Notf Rettungsmedizin 2023; 26: 4–14. doi:10.1007/s10049-022-00990-5
[2] Shapiro SE, Rosenfeld AG, Daya M, et al. Determining Severe Respiratory Distress in Older Out-of-Hospital Patients. Prehosp Emerg Care 2005; 9: 310–317. doi:10.1080/10903120590962067
[3] Gravelyn TR. Respiratory Rate as an Indicator of Acute Respiratory Dysfunction. JAMA J Am Med Assoc 1980; 244: 1123. doi:10.1001/jama.1980.03310100041029
[4] Siniorakis E, Arvanitakis S, Tsitsimpikou C, et al. Acute Heart Failure in the Emergency Department: Respiratory Rate as a Risk Predictor. Vivo Athens Greece 2018; 32: 921–925. doi:10.21873/invivo.11330
[5] Strauß R, Ewig S, Richter K, et al. The Prognostic Significance of Respiratory Rate in Patients With Pneumonia. Dtsch Ärztebl Int 2014; doi:10.3238/arztebl.2014.0503
[6] North JB, Jennett S. Impedance pneumography. Lancet Lond Engl 1972; 2: 828–829. doi:10.1016/s0140-6736(72)92196-4
[7] Pahal P, Goyal A. Central and Peripheral Cyanosis. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2024
[8] Manger B, Lindner A, Manger K, et al. [Hypertrophic osteoarthropathy. Bamberger-Marie disease]. Z Rheumatol 2011; 70: 554–560. doi:10.1007/s00393-011-0813-7
[9] See K. Approach to acute respiratory failure for frontline clinicians. Singapore Med J 2022; 63: 740. doi:10.4103/singaporemedj.SMJ-2022-002
[10] Farkas J. ABG, VBG, and pulse oximetry. Internet Book Crit Care 2023;
[11] Jörg M, Öster M, Wretborn J, et al. Agreement of pCO2 in venous to arterial blood gas conversion models in undifferentiated emergency patients. Intensive Care Med Exp 2023; 11: 80. doi:10.1186/s40635-023-00564-w
[12] Istrail L. The pocus manifesto: expanding the limits of our physical exam with point-of-care ultrasound. USA? pocusmeded.com; 2021


Ich warte gespannt auf den zweiten Teil! Sehr unterhaltsam und informativ – Danke!!
Vielen Dank für das Lob! Ich arbeite gerade an Teil II und III. Ist halt etwas aufwändig doch sinnvollen Content zu erstellen. Aber ich geb mir Mühe! LG
Vielen Dank, vergnüglich zu lesen und informativ ( wie alles was es hier zu lesen gibt) Freu mich auch auf die Therapie.
Liebe Elisa! Danke für das tolle Lob! Ich bemühe mich besser zu werden. Teil II und III zum Thema sind gerade in Arbeit. Ich hoffe die gefallen dir dann auch. Stay tuned! Lg Isabelle